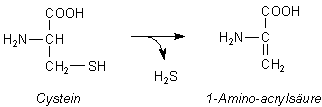
Schwefel im Ei
Experimente:
Versuch: Erhitzen von schwefelhaltigen biochemischen Substanzen
Versuch: Wie funktioniert das Reinigen von angelaufenem Silber?
Das Element Schwefel ist typischer Bestandteil von Biomasse. Deshalb auch im
Ei enthalten. Schließlich braucht das
wachsende Huhn, da es (bis auf die Luft) keinen Austausch mit der Umgebung hat, viele Substanzen
zum Aufbau und muss sie dabei selbst zur Verfügung haben. Man denke allein an das besonders
schwefelreiche Protein Keratin, aus dem Horn und Federn bestehen.
Wenn man sein Ei mit dem Silberlöffel verzehrt, erlebt man seine Überraschung: Der Silberlöffel läuft rasch an. Eigentlich sollte Silber nicht oxidiert werden. Dahinter steckt jedoch, dass das gebildete Silbersulfid sehr stabil ist und der mit seiner Bildung verbundene Energiegewinn die Oxidation erlaubt. Man kann auch sagen, dass in der Anwesenheit von Schwefelwasserstoff das Redoxpotential des Silbers sinkt, oder dass es dabei schlicht unedler wird.
Der Geruch nach Schwefelwasserstoff ist für faule Eier typisch. Das giftige Gas entsteht vor allem aus der freien oder gebundenen Aminosäure Cystein.
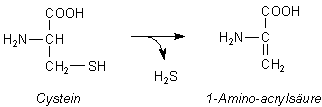
Bildung von Schwefelwasserstoff aus Cystein
Wie bekommt man den Silberlöffel wieder sauber? Dazu gibt es verschiedene Methoden. Die beschreiben wir in einem Tipp des Monats.
Weitere Texte zum Thema „Schwefel“