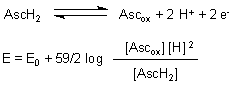
Allgemeines zu den potentiometrischen Redox-Titrationen am Beispiel der Ascorbinsäure
Experimente:
Versuch: Potentiometrische Titration der Ascorbinsäure mit Kaliumhexacyanoferrat(III)
Bei Redoxmessungen sind natürlich die potentiometrischen Titrationskurven am
aussagekräftigsten. Denn sie lassen direkt die Verschiebung des
Redoxgleichgewichts durch das oxidierende oder reduzierende Titrationsmittel
erkennen. Außerdem lassen sie eine quantitative Bestimmung von Stoffen zu, auch
wenn es dazu keine geeigneten Farbreaktionen gibt. In der Laborroutine werden
solche Titrationen automatisch durchgeführt, da das Ende der Titration, der
Äquivalenzpunkt, anhand eines Spannungssprungs erkennbar wird.
Der Algorithmus der Redox-Titrationskurve ist die Nernstsche Gleichung, hier beispielhaft für das Zwei-Elektronen-Redox-Gleichgewicht der Ascorbinsäure geschrieben.
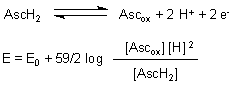
E0 = +0,06 V bei pH = 7 und 25 °C
Die Redox-Titrationskurven
Trägt man die gemessenen Spannungswerte gegen die Zugabe an Titriermittel auf, so erhält
man Titrationskurven wie im folgenden Bild gezeigt.
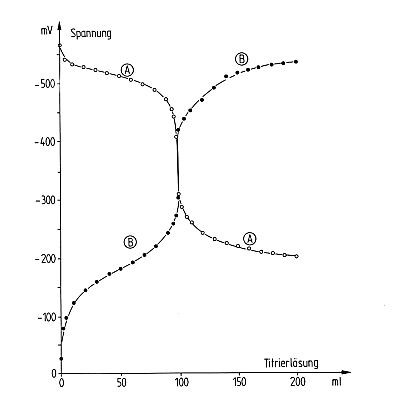
Wechselseitige Titration von Ascorbinsäure mit Hexacyanoferrat(III);
A: Vorlage Ascorbinsäure, B: Vorlage HCF(III)
Elektroden: Platin gegen Hg/HgSO4
Legt man Ascorbinsäure vor und titriert mit dem Oxidationsmittel Hexacyanoferrat(III)
(abgekürzt HCF(III)), so steigt das Potential der Lösung und durchläuft dabei zunächst
einen Wendepunkt mit flacher Wendetangente. (Beachten Sie die negative Skalierung der Ordinate.)
Im Äquivalenzpunkt bei 100 ml Zugabe erkennen wir einen mehr oder weniger großen Anstieg der
Kurve, dessen Umfang von der Differenz der E0-Werte der beteiligten zwei Redoxsysteme abhängt.
Dann folgt der Kurvenast des überschüssigen Oxidationsmittels, das sich mit der bei der
Oxidation von AscH2 entstandenen äquivalenten Menge an HCF(II) ins Gleichgewicht setzt.
Legt man umgekehrt HCF(III) vor und titriert mit dem Reduktionsmittel Ascorbinsäure, so sinkt
das Potential entsprechend.
Die Kurven A und B sollten also spiegelbildlich sein. Auffallend ist aber, dass die Steigung
der beiden Kurven A und B unterschiedlich sind. Die bei der Vorlage von Ascorbinsäure erhaltene
verläuft deutlich flacher. Das liegt daran, dass bei der Oxidation von Ascorbinsäure pro Molekül
zwei Elektronen abgegeben werden, HCF(III) jedoch nur ein Elektron aufnimmt. Deshalb verhalten
sich die Steigungen der Kurven A und B wie 1:2. Das folgt direkt aus der Nernstschen Gleichung
(siehe oben), da die Elektronenzahl als Divisor in den Koeffizienten vor dem Logarithmus eingeht.
Der Spannungswert bei Zugabe des halben Äquivalents an Titriermittel ist übrigens nur näherungsweise der E0-Wert des vorgelegten Redoxsystems. Die so erhaltenen Werte weichen nämlich von denen der Literatur um +100 bis +200 mV ab, da bei unseren Versuchen nicht unter Ausschluss von Luftsauerstoff gearbeitet wird.
Was passiert bei Redoxmessungen an der Platinelektrode?
Redoxvorgänge sind charakterisiert durch die "Konzentration" der ausgetauschten
Elektronen. Um die "Menge" an ausgetauschten Elektronen zu bestimmen, bedient
man sich inerter Metallelektroden wie z. B. aus Platin. Diese Elektrode lädt sich je
nach den Vorgängen, die an ihrer Oberfläche katalysiert ablaufen, gegenüber einer
Bezugselektrode entsprechend unterschiedlich auf. Als Beispiel soll die Titration von
Ascorbinsäure mit Kaliumhexacyanoferrat(III) besprochen werden. Letzteres kürzen
wir mit KHCF(III) ab.
Zu Beginn liegt nur Ascorbinsäure vor. An der Elektrodenoberfläche stellt sich langsam das Redoxgleichgewicht mit der Dehydroform ein.
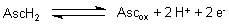
Die Gleichgewichtseinstellung bewirkt, dass sich das Platinblech zunehmend negativ
auflädt. Wegen der langsamen Gleichgewichtseinstellung beobachtet man folglich zu
Beginn der Titration eine nur sehr langsame Potentialeinstellung. Dies kann man auch
mit Hilfe der oben angeführten Nernstschen Gleichung erklären: Setzt man [Ascox] = 0,
so geht E -> minus unendlich.
Bei Zugabe des Oxidationsmittels nimmt [AscH2] ab; das Gleichgewicht verschiebt sich
zunehmend nach rechts. Damit sinkt auch die "Konzentration" der Elektronen, die an
der Platinelektrode ausgetauscht werden. Folglich steigt das Potential mit der Zugabe
von Titriermittel an. Die entstehenden Hexacyanoferrat(II)-Ionen beeinflussen das
Potential an der Platinelektrode kaum, da sie an die negativ aufgeladene Elektrode
keine Elektronen abzugeben vermögen. Damit liegt das Gleichgewicht
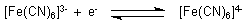
gänzlich auf der rechten Seite.
Wenn die Ascorbinsäure quantitativ zu Dehydroascorbinsäure umgesetzt ist, kann sich an der Platinelektrode das Gleichgewicht einstellen. Überschüssige Hexacyanoferrat(III)-Ionen entziehen der Elektrode Elektronen, womit das Potential sprunghaft ansteigt, der Äquivalenzpunkt der Titration ist erreicht. Bei weiterer Zugabe von rotem Blutlaugensalz setzt sich dieses mit dem vorhandenen gelben Blutlaugensalz ins Gleichgewicht; das Potential nimmt von nun an nur wenig zu.
Was bei Redox-Titrationen zu beachten ist
Bei den in den folgenden Abschnitten und der zugehörigen Versuchsgruppe
beschriebenen Titrationen ist stets folgendermaßen vorzugehen:
| - | Als Spannungsmessgerät dient ein hochohmiges Voltmeter. Auf richtige Polung achten! Wenn die Spannung bei Zugabe eines Oxidationsmittels sinkt, muss man umpolen. |
| - | Die Elektroden sind
I. Indikatorelektrode (Redoxelektrode): Platin- oder Silberblech. Verfügt man über keine Platinelektrode, so setzt man eine Leitfähigkeitsmesszelle ein, bei der man nur einen Pol mit dem Spannungsmessgerät verbindet. II. Bezugselektrode (Referenzelektrode):
|
| - | Die gemessenen Potentiale (Egem) sind um den Wert des
Bezugspotentials zu korrigieren, wenn man die gemessenen Werte mit denen der Literatur (Egegen H2)
vergleichen will:
Egegen H2 = Egem + ERef Beispiel:
- 300 mV + 656 mV = 356 mV Hätte man als Bezugselektrode eine Hg / Hg2Cl2-Elektrode eingesetzt, so hätte man nur eine Spannungsdifferenz von +128 mV gemessen. Dies lässt sich auch graphisch zeigen: |
|
| - | Während der gesamten Titration wird die Lösung konstant gerührt (Magnetrührer). |
| - | Zu Beginn der Titration muss bei Vorlage eines Stoffs in der reduzierten oder oxidierten Form etwa 10 Minuten auf die Potentialeinstellung gewartet werden. Nach Zugabe des Titriermittels reicht eine Minute. Dieser Wert sollte bei jeder Ablesung eingehalten werden. Eine Titration ist ohne Unterbrechung durchzuführen. |
| - | Vor der Titration ist zu überlegen, wie viele Titrationsschritte man benötigt, damit die Aufnahme der Titrationskurve nicht zu lange dauert. Legt man zum Beispiel 50 ml einer 0,1 molaren Lösung vor, so reichen 5 ml-Schritte bei Verwendung einer gleichmolaren Titriermittellösung aus. |
Weitere Texte zum Thema „Ascorbinsäure“