Versuch: Untersuchung der Lösemittel in Lacken und Klebstoffen
Schülerversuch; 20 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Grundlage
In diesem Versuch wird zunächst das Lösemittel aus einem Lack
abdestilliert. Anschließend wird die Zusammensetzung untersucht, wobei nur die Anwesenheit von
Alkoholen, Aromaten, Ketonen, Carbonsäureestern und Halogenkohlenwasserstoffen
geprüft wird.
Geräte
Reagenzgläser, dazu passender durchbohrter Stopfen mit gebogenem Glasrohr,
Papiertaschentücher, Bechergläser, Bunsenbrenner, Tropfpipetten.
Chemikalien
Probe eines Kunstharzlackes (Xn,F), Aluminiumchlorid (AlCl3; wasserfrei) (C),
Chloroform (Xn), 2,4-Dinitrophenylhydrazinlösung (w = 2 % in Eisessig) (C,Xn),
Methanol (T,F), alkoholische Phenolphthaleinlösung (F), Natronlauge
(w = 0,1 % in Methanol) (Xi,T,F), Cer(IV)-ammoniumnitrat (Xi), Salpetersäure (c = 2 mol/l) (Xi),
Kalilauge (c = 1 mol/l) (C), Silbernitratlösung (w = 5 %) (Xi).

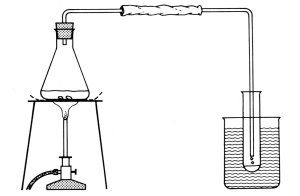
Einfache Destillationsapparatur
Durchführung
1 Abtrennen des Lösemittels aus einem Lack
Ein Demonstrationsreagenzglas wird zu einem Drittel mit Lack gefüllt. Man baut
sodann die in dem Bild gezeigte Apparatur auf und beginnt mit der Flamme des
Bunsenbrenners vorsichtig den Lack - beginnend bei den oberen Schichten - zu
erhitzen. Nach kurzer Zeit destilliert das im Lack enthaltene Lösemittel bzw.
Lösemittelgemisch als farblose Flüssigkeit ab und kondensiert in dem als Vorlage
dienenden Reagenzglas. Im Verlaufe von wenigen Minuten ist die Destillation
beendet. Es bleibt eine zähflüssige Masse zurück.
Meist ist das Destillat durch mitgerissene Zersetzungsprodukte schwach gefärbt. Aus
diesem Grunde sollte gegen Ende der Destillation der Lack nicht zu stark erhitzt
werden, da sonst pyrolytische Abbaureaktionen einsetzen.
2 Abtrennen des Lösemittels aus einem Klebstoff
Die in Haushaltsklebern wie UHU enthaltenen Lösemittel sieden meist niedriger als
die in Lacken. Besonders am Anfang der Destillation muss wegen starker
Blasenbildung vorsichtig erhitzt werden. Wurde die Destillation schonend
durchgeführt, kann die zurückbleibende Klebstoffmasse wieder in dem erhaltenen
Destillat aufgelöst werden.
3 Untersuchung eines Lacklösemittels
Hinweis
Da Lacke je nach verwendetem Grundstoff, Anwendungsbereich und Hersteller
unterschiedliche Lösemittel enthalten, werden nicht immer alle Nachweise positiv
ausfallen!
1 Prüfung auf Alkohole
Cerammoniumnitrat-Reagenz wird im Überschuss zur Probe gegeben. Alkohole und
Phenole ergeben eine Rotfärbung. Zur deutlicheren Farberkennung gibst du die
gleiche Menge an Reagenzlösung zu Wasser.
2 Prüfung auf Aromaten
Erhitze in einem Reagenzglas wird über dem Bunsenbrenner eine Spatelspitze
Aluminiumchlorid, wobei dieses sublimiert und sich an den kälteren Glaswänden als
gelber Ring niederschlägt. Lasse nun vorsichtig einige Tropfen einer Mischung aus
gleichen Mengen Lösemittel und Chloroform zulaufen. Eine Verfärbung zeigt die
Anwesenheit aromatischer Verbindungen an.
3 Prüfung auf Ketone
1 ml des Lösemittels wird in 2 ml Methanol gelöst und anschließend mit 1 ml der
2,4-Dinitrophenlyhydrazinlösung versetzt. Die durch Reaktion mit Ketonen gebildeten
Hydrazone fallen als fester Niederschlag aus.
4 Prüfung auf Carbonsäureester
In einem Reagenzglas wird eine Mischung aus 1 ml des Lösemittels und 3 ml
Methanol mit wenigen Tropfen der Phenolphthaleinlösung versetzt. Anschließend wird
aus einer Tropfpipette so viel methanolische Natronlauge zugegeben, dass gerade
eine Rotfärbung zu erkennen ist. Erwärme 5-10 min. auf dem Wasserbad. Entfärbung
oder deutliche Farbaufhellung weisen auf Carbonsäureester hin.
5 Prüfung auf Halogenkohlenwasserstoffe
Diese Prüfung erfolgt durch den Lehrer mittels der bekannten Beilsteinprobe (-> grüne
Flammenfärbung eines zuvor in das Lösemittel eingetauchten sauberen
Kupferbleches). Abzug!
Eine andere Prüfmethode beruht auf der Substitution von Halogen- durch
Hydroxylgruppen. Hierzu kochst du eine Probe des Lösemittels in Kalilauge. Dann
wird salpetersauer eingestellt und Silbernitratlösung zugegeben. Ein weißer
Niederschlag von Silberhalogenid weist auf das Vorliegen von
Halogenkohlenwasserstoffen hin.