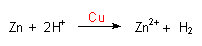
Versuch: Vom Lokalelement zum Voltaelement
Schülerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Vorbemerkung
Anhand der Korrosionsvorgänge kann hervorragend der Übergang zu den
galvanischen Elementen (Typ Volta-Element) erfolgen.
Geräte
Reagenzgläser, Reagenzglasständer, Becherglas (250 ml), Multimeter, niederohmiger
Elektromotor, Kabelmaterial, 2 Krokodilklemmen.
Chemikalien und Material
Schwefelsäure (c = 0,5 mol/l) (Xi), Kupfersulfatlösung (w = 0,1 %), Zinkgranalie,
saubere Bleche von Kupfer und Zink.
Durchführung
1 Vorversuch
In zwei Reagenzgläser geben wir jeweils etwa 10 ml Schwefelsäure. Dann werfen wir
in beide je eine Zinkgranalie ein. Entgegen jeglicher Erfahrung beobachten wir kaum
Gasentwicklung. Die Zinkgranalien sind erstaunlich stabil.
Dann geben wir zu einem Reagenzglas drei Tropfen der Kupfersulfatlösung. Schon
nach kurzer Zeit beginnt eine starke Gasentwicklung, die Zinkgranalie beginnt sich
offenbar zu zersetzen. Wir beobachten weiter, dass sich Kupfer auf der Granalie
abscheidet.
Zn + Cu2+ ———> Zn2+ + Cu
Offenbar spielt Kupfer die Rolle eines Katalysators.
2 Untersuchung der katalytischen Rolle des Kupfers
Wir nehmen nun ein Becherglas, das wir halb mit frischer Schwefelsäure füllen. Wir
halten das Zinkblech und das Kupferblech mit Hilfe von Krokodilklemmen hinein. Es
passiert nichts. Wenn wir jedoch das Zinkblech mit dem Kupferblech berühren,
beginnt eine deutliche Gasbildung - bemerkenswerterweise am Kupfer.
Das Kupfer zieht bei Kontakt als Metall mit größerer Elektronegativität
Elektronen aus dem Zink zu
sich herüber und nutzt diese zum Entladen der Wasserstoff-Ionen. Gleichzeitig
zersetzt sich das Zink. Kupfer katalysiert also die Redoxreaktion zwischen Zink und
Wasserstoff-Ionen.
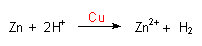
Eine solche Anordnung nennt man auch Lokalelement.
3 Vom Lokalelement zum galvanischen Element
Wenn Elektronen über den Kurzschluss zwischen den Metallen des Lokalelements
fließen, sollten diese auch über einen äußeren, metallischen Leiter, der das Zink- und
das Kupferblech miteinander verbindet, fließen und dabei Arbeit leisten können.
Wir verbinden die beiden Bleche mit Hilfe der Krokodilklemmen mit einem Kabel und
halten sie in die Schwefelsäure. Obwohl sich die Bleche nicht direkt berühren,
beobachten wir wieder die Gasentwicklung am Kupferblech.
Wir schalten ein Multimeter zwischen die Elektroden; die Spannung beträgt etwa 1 Volt. Ein kleiner Elektromotor läuft.
Ein leitend geöffnetes Lokalelement ist also ein galvanisches Element. Im speziellen Fall haben wir es mit dem Volta-Element zu tun.
Wir betrachten die formale Ähnlichkeit zwischen den beiden o. a. Reaktionsgleichungen und erkennen, dass es sich bei der ersten Gleichung um die Beschreibung des Daniell-Elements handelt.