 |
| Bild 1: Chrom oder nicht Chrom, das ist hier die Frage
(Foto: Blume) |
Ohne Chrom keine Zierde
 |
| Bild 1: Chrom oder nicht Chrom, das ist hier die Frage
(Foto: Blume) |
Experimente:
Versuch: Nachweis der Oxidschicht auf Metallen mit Hilfe
elektrischer Leitfähigkeit
Versuch: Redoxpotentiale von Al, Cr und Fe im Vergleich
Versuch: Herstellen von Chromat durch Elektrolyse
Versuch: Herstellen von Dichromat aus Chromat
Versuch: Reduktion von Chromat
Versuch: Entfernung von Chromat-Ionen aus galvanischen
Spülwässern durch Anionenaustausch
Versuch: Demonstration der Trennung von MnO4 und
CrO4-Ionen an Aluminiumoxid
Versuch: Rostet Eisen mit Metallüberzügen?

Bild 2: Metallisches, gebrochenes Chrom (Länge des Stücks 7 cm)
(Foto: Blume)
Chrom ist ein Schwermetall, das ein niedrigeres Redoxpotential hat als Eisen.
E0 (Cr/Cr3+) = - 0,744 Volt (pH = 0)
E0 (Fe/Fe2+) = - 0,440 Volt (pH = 14)
Obgleich Chrom somit unedler ist als Eisen, dient es als Überzugsmetall zu dessen Schutz vor Korrosion. Denn es ist anders als Eisen mit einer feinen, aber extrem dichten Oxidschicht überzogen (-> Versuch), scheint also im neutralen pH-Bereich edler als Eisen zu sein (Passivierung). Das ergeben auch die Messungen des Redoxpotentials (-> Versuch). Chrom behält trotz dieser Oxidschicht weiterhin seinen bekannten, kalten Metallglanz. (Dieses Verhalten zeigt auch Aluminium.)

Bild 3: Durch häufigen Gebrauch abgeschliffener verchromter Schlüsselring aus Stahl.
Man erkennt das unter der Chrombeschichtung liegende Kupfer
(Foto: Blume)
Das Hochglanzverchromen von Eisen setzt eine vorherige galvanische
Verkupferung oder Vernickelung des Werkstücks voraus. Auf dem so vorbehandelten
Eisenstück wird dann in einer schwefelsauren Lösung von Chrom(VI)-säureanhydrid kathodisch
Chrom abgeschieden.
CrO3 + 6 H+ + 6 e- ———> Cr + 3 H2O
Dieses Verfahren kann leider in der Schule oder gar von Laien/Autobastlern nicht nachgeahmt werden. Wie es in der Praxis gemacht wird, beschreiben wir auf einer Extra-Webseite.
Wenn die Chromschicht, die das Eisen schützt, verletzt ist, baut sich allerdings ein Lokalelement auf; die Korrosion des Eisens schreitet nun besonders rasch voran (-> Versuch).
Chromverbindungen sind giftig. Chrom(III)-Verbindungen
gelten als allergen, feste Chrom(VI)-Verbindungen sollen cancerogen sein. In Lösungen können sie aber als Xn-Stoffe eingestuft werden.Chromate
stellt man her, indem man Chrom anodisch oxidiert (-> Versuch).Cr + 4 H2O ———> CrO42- + 4 H2
Durch Ansäuern werden die gelben Chromate in die technisch wichtigeren roten Dichromate überführt (-> Versuch):
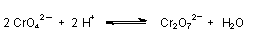
Es handelt sich hier um ein chemisches Gleichgewicht, das durch die Konzentration der Säure gesteuert wird.
Bei der galvanischen Verchromung fallen stark chromathaltige Restlösungen an, die sorgfältig entsorgt werden müssen. Das geschieht einmal durch Reduktion und anschließender alkalischer Fällung des Chrom(III)-hydroxids (-> Versuch). In der Schule können Glucoselösungen zur Reduktion dienen.
CrO42- + 3 e- + 8 H+ ———>Cr3+ + 4 H2O
Cr3+ + 3 OH- ———> Cr(OH)3
Man greift aber auch zu Anionenaustauschern, mit denen man die Chromate wieder aufkonzentriert und dem Galvanisierbad wieder zuführen kann (-> Versuch und Versuch).
Weitere Texte zum Thema „Auto“