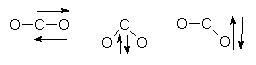
Der Treibhauseffekt genauer betrachtet
Wie können Moleküle überhaupt Wärme speichern?
Wärme ist zweierlei
Einmal ist sie kinetische Energie. Der Stoß von Molekülen auf entsprechende
Sensoren in der Haut löst das Gefühl "Wärme" aus. Beim Erwärmen eines Gases
bewegen sich die Moleküle rascher, die Zahl der Stöße nimmt zu.
Wärme ist aber auch elektromagnetische Strahlung. Wir kennen dies von der
Rotlichtbestrahlung beim Arzt oder vom wärmestrahlenden schwarzen Ofen. Ein
großer Teil der uns erreichenden Sonnenstrahlung besteht aus dieser Energieform.
Die Frequenz dieser elektromagnetischen Schwingungen liegt im Infrarotbereich (IR).
Strahlung durchdringt die Atmosphäre nur begrenzt. Der Grund ist, dass Spurengase
wie CO2 neben der UV-Strahlung (< 400 nm) auch einen Teil der IR-Strahlung
(> 800 nm) absorbieren. Dabei treten die Dipole und Elektronen im Molekül in
Wechselwirkung mit der elektromagnetischen Schwingung; sie werden "angeregt".
Man kann diesen Vorgang mit der Absorption von Radiowellen durch eine Antenne
vergleichen.
Nun darf man sich Moleküle nicht als starre Partikel vorstellen, wie man sie aus dem
Molekülmodell-Baukasten her kennt, sondern als ständig schwingende Objekte.
So kann das CO2-Molekül z. B. folgende Grundschwingungen zeigen, die sich zu
zahlreichen Oberschwingungen kombinieren:
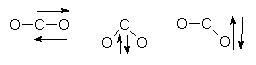
Einige Grundschwingungen des CO2-Moleküls
Diese Anregung erfordert - anders als bei einer Radioantenne - die Absorption von
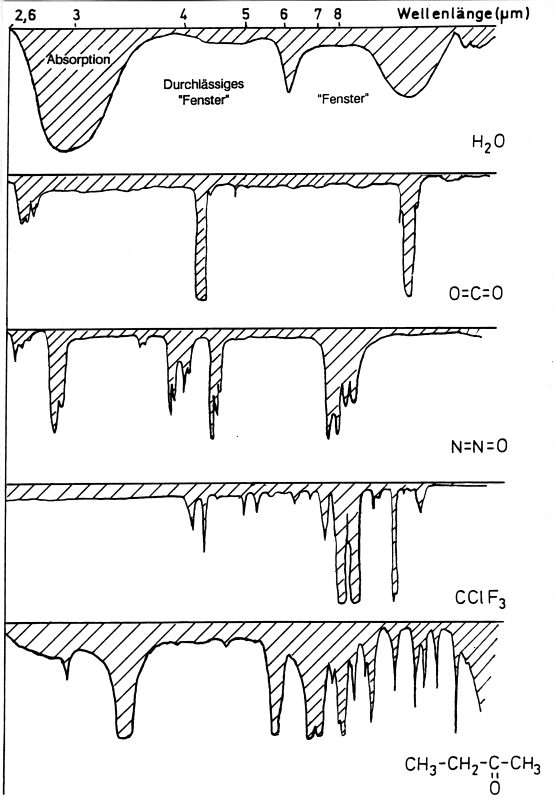
präzise definierten Energiepaketen, den Quanten (E = h · u). Jeder Stoff zeigt sein
spezifisches Absorptionsmuster (Spektrum), an dem er sogar erkannt werden kann. Je
komplizierter ein Stoff aufgebaut ist, desto komplizierter ist auch sein IR-Spektrum (->
Bild).
|
Umgekehrt erfolgt auch die Abgabe der Energie nur quantenweise. Folglich konservieren die Moleküle die Wärmestrahlung in Schwingungszuständen.
Was ist, wenn alle Moleküle mit Energie gesättigt sind? Die Moleküle können ihre
Energie auch wieder abgeben.
Dies kann zunächst durch einen Stoß mit einem anderen Molekül erfolgen. Dabei wird
nur die genau einem Quant entsprechende Energiemenge als Schwingungs- oder als
kinetische Energie auf andere Moleküle übertragen. Wichtiger ist die sofortige
Wiederabstrahlung, die Fluoreszenz. Da bei diesem Prozess die elektromagnetische
Strahlung langsam immer energieärmer, d. h. langwelliger wird, wandelt sich auch die
UV-Strahlung von der Sonne zunehmend in IR-Strahlung und somit in Wärme um. Dies
wird durch die Ausdünnung des UV-abschirmenden Ozongürtels noch gefördert.
Fluoreszenz erfolgt in alle Richtungen. Oberhalb einer Höhe von ca. 30 km, in der
Stratosphäre, wird mit zunehmendem CO2-Gehalt immer mehr der von außen
kommenden Strahlung durch ungerichtete IR-Fluoreszenz in den Weltraum
zurückgestrahlt ("gespiegelt"). Dies führt zu einer starken Abkühlung der Stratosphäre.
Andererseits wird die vom erwärmten Erdboden aus in Richtung auf den Weltraum
abgestrahlte Energie von Gasmolekülen absorbiert und durch Fluoreszenz
abgegeben. Im Allgemeinen werden die benachbarten Moleküle diese Energie
auffangen und ihrerseits weitergeben. Damit wird die Wärme gleichmäßig in der
Troposphäre verteilt.
Nicht nur CO2 ist ein klimawirksames Gas, sondern auch andere komplex gebaute Moleküle wie das Distickstoffoxid N2O, das in Milliarden Tonnen pro Jahr durch mikrobielle Tätigkeit oder bei Verbrennungsprozessen emittiert wird. Gleiches gilt für Methan (CH4), die FCKW oder Lösemitteldämpfe. Auch Ozon ist ein bedeutendes Spurengas mit Treibhauswirkung.
| Tabelle: Relativer Treibhauseffekt je Molekül | |
| Kohlenstoffdioxid | 1 |
| Methan | 32 |
| Distickstoffoxid | 150 |
| Ozon | 2000 |
| FCKW | 15000 |
| Lösemittel wie Ester | > 50000 |
Vergessen wollen wir dabei auch nicht das Wasser. Ausgerechnet dessen Bereich mit fehlender Absorption ("Fenster") verschließen die anderen Spurengase. Daher rührt deren besondere Effektivität auch in geringsten Konzentrationen.
Weitere Texte zum Thema „Auto“