
Informationen zur Bodenzone
(Pedosphäre) für Umweltwissenschaften
1 Überblick
Die Pedosphäre ist die schmale Reaktionszone zwischen Erdkruste (Lithosphäre) und
Atmosphäre.
Die Mächtigkeit des Bodens schwankt zwischen wenigen Zentimetern bis zu 2 Metern. Er ist
das Umwandlungsprodukt von mineralischen und organischen Substanzen.
Der Boden wird von allen Sphären beeinflusst und wirkt auf diese zurück (-> Bild 1). Dabei
wird der Boden in seiner Zusammensetzung und seinen Eigenschaften von aufbauenden
und abbauenden Faktoren gesteuert. Diese können physikalische und chemische
Wirkungen ausüben.

Bild 1: Wechselbeziehungen zwischen den Sphären
Über die Nutzung der Bodenoberfläche in Deutschland gibt die Tabelle 1 Aufschluss.
| Tab. 1: Nutzung der Oberfläche in Deutschland | |
| 56,0 % | Landwirtschaft |
| 29,5 % | Wald |
| 1,7 % | Oberflächenwasser |
| 5,5 % | Gewerbe- und Wohngebiet |
| 4,7 % | Schienenwege, Straßen, Flugplätze |
1.1 Bodenaufbau und Bodenzerstörung
Bodenaufbauende Faktoren
| - | Mineralien
Diese entstehen durch Verwitterung des Muttergesteins. |
||||||||||
| - | Humusstoffe
Sie bilden sich durch Zersetzung postmortaler Biomasse hauptsächlich durch mikrobielle Tätigkeit und durch katalytische Prozesse unter Mitwirkung anorganischer Bodenbestandteile. Die für Humusstoffe typischen Huminsäuren sind äußerst kompliziert zusammengesetzte Gemische von wasserlöslichen, sauren Polymeren. Ihre Strukturen sind wegen ihrer Vielfältigkeit nur wenig untersucht und bekannt. Typisch sind peptidartig verbundene Aminosäuren, über Etherbrücken kondensierte Aminozucker, polycyclische und einfache Aromaten (vor allem Phenole aus dem Lignin) und Heterocyclen, welche über Ether- oder CH2-Brücken verknüpft sind. Vor allem findet man auch polymere Polycarbonsäuren, welche auf Citronensäure oder 3-Ketoglutarsäure zurückzuführen sind. |
||||||||||
| - | Feuchtigkeit
Hierunter versteht man Wasser im Porenraum des Bodens. Es löst Mineralien und transportiert deren Ionen sowie Protonen. |
||||||||||
| - | Luft
Der Luftanteil muss mindestens 50 % des Hohlraumvolumens betragen, um eine Eigenverdichtung des Bodens zu verhindern. Damit wird der Luftaustausch ermöglicht. Dieser ist notwendig, um bodenversauernde anaerobe Gärungsprozesse zu unterbinden, durch die Schwefelwasserstoff, Methan und organische Säuren freigesetzt werden. Der Sauerstoffgehalt wird außerdem durch Algen und Pflanzenwurzeln reguliert. |
||||||||||
| - | Lebewesen
Pro ha (100 m · 100 m) Boden sind (ohne Bewuchs) ca. 25 t Lebewesen vorhanden. Im einzelnen findet man folgende Organismen:
|
Bodenabbauende Faktoren
1.2 Bodenchemie
Der Boden ist ein hochspezialisiertes Ökosystem mit komplexen Reaktionen. Er gleicht dabei nicht so sehr einer Haut, sondern eher einer hochleistungsfähigen Membran. Aus diesem Grunde soll etwas genauer auf die chemischen Eigenschaften eingegangen werden.
Der pH-Wert
Der pH-Wert des Bodens liegt natürlicherweise zwischen 4-9. Unter pH 6 muss bereits
gekalkt werden, um Pflanzenschädigung zu verhindern.
Wichtige Bestandteile des Bodens
Tonmineralien
Die typischen Tonmineralien sind Schichtsilikate (-> Bild 2; z. B. Montmorillonit). Sie
entstehen durch Verwitterung von Glimmer und Feldspäten.
Tonmineralien lagern große Mengen Wasser relativ fest in ihre Schichtgitter ein und sind
deshalb auch wenig wasserdurchlässig. (Aus diesem Grunde bilden Tone oft
Quellhorizonte.)
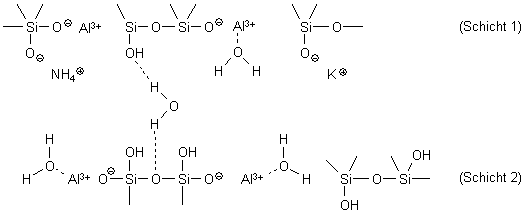
Bild 2: Gitter von Tonmineralien
Typisch für Tonmineralien ist, dass anstelle von Si4+-Atomen je ein Al3+- oder Mg2+-Ion treten kann. Durch den Wertigkeitswechsel resultieren negative Überschussladungen, an die positiv geladene mineralische Düngerbestandteile gebunden werden.
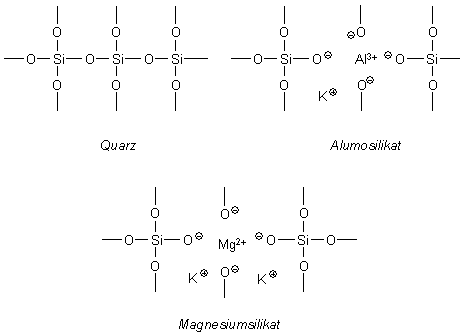
Bild 3: Quarz und Silikate. Gezeigt ist auch die Bindefähigkeit für K+-Ionen
Tonmineralien wirken als Ionenaustauscher:
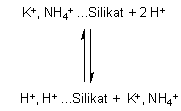
Je saurer das Milieu ist, desto nährstoffarmer sind Tonböden. Bei stärkerem Säureeintrag (z. B. durch Regen) kann die Grundstruktur der Tonmineralien durch Herauslösen von Al3+-Ionen zerstört werden. Damit verliert der Boden die Bindungsfähigkeit für Kationen. Zusätzlich sind die freigesetzten Aluminium-Ionen pflanzen- und wahrscheinlich auch für manche Tiere toxisch. Außerdem binden sie Phosphat und entziehen es der Pflanzenverfügbarkeit.
Die Verwitterung von Tonmineralien ist abhängig vom pH-Wert und von der Temperatur. Je weiter südlich die Böden liegen, desto ausgelaugter, silikatärmer wird der Boden. Damit fällt auch die Bindungsfähigkeit weg. Die Böden werden schließlich ziegelsteinartig hart. Man nennt diesen Zustand lateritisch.
Humusstoffe
Humusstoffe sind saure Bodenbestandteile, die aus Biomasse entstanden sind.
Normalerweise werden sie biologisch vollständig abgebaut. Im anderen Fall sind sie
Ausgangsmaterial für Torf, Braunkohle (usw.). Die typischen Huminsäuren sind sehr gute
Komplexbildner und halten deshalb mineralische Düngerbestandteile (aber auch
Schwermetall-Ionen) besonders gut fest. Deren Mobilisierung erfolgt erst, wenn die
Humusstoffe selbst abgebaut werden. Deshalb ist reiner Humus wenig fruchtbar. Beim
Ansäuern entlässt Humus ionenaustauscherartig alle Kationen. Deshalb sind Moore völlig
unfruchtbar, das Moorwasser ist ausgesprochen weich. Regenwaldwasser
ist ionenarm wie destilliertes Wasser.
Verteilungsgrad
Die Größe der Bodenbestandteile (Verteilungsgrad) ist für die Bodenqualität von höchster
Wichtigkeit.
| - | Stein- und sandreiche Bodenstrukturen lassen Wasser und gelöste Stoffe rasch durchsickern, sind wärmehaltend und wenig fruchtbar. |
| - | Staub- und schlickhaltige Bodenstrukturen wie Löß fixieren Wasser und Mineralien reversibel, sind kühl und sehr ertragreich. |
| - | Kolloide Lehm- und Tonböden binden Wasser zu stark, sind daher kalt und schlecht durchlüftet. |
| - | Humöse Böden sind Mischböden. Die beste Zusammensetzung ist 60 % Löß, 10 % Humus, 30 % Tonmineralien. Ein solcher Boden ist krümelig und verspricht höchste Fruchtbarkeit. |
1.3 Bodentypen
In Deutschland sind besonders drei Typen wichtig:
Bleicherde oder Podsol-Böden
Diese ausgelaugten Heideböden ("weiße Asche") weisen eine ausgesprochen saure
Bodenlösung mit wenigen, nicht quellfähigen Tonmineralien auf. Daher werden die meisten
Mineralstoffe ausgewaschen und bilden tiefergelegene, lateritartige Zonen (Toneisenstein,
Raseneisenerz). Die Böden sind meistens anmoorig.
Braunerden
Diese so genannten braunen Waldböden sind eher neutral bis schwach sauer. Sie enthalten
braunen Humus und quellfähige Tonmineralien. Diese binden bevorzugt Mineralien, die
leicht ausgetauscht werden können.
Schwarzerdeböden
Diese für Steppen typischen, stärker humösen Böden sind vor allem im Osten Deutschlands
anzutreffen. Künstlich bereitete Gartenerde besitzt die gleichen Eigenschaften.
1.4 Horizonte unter der Bodenschicht
Unter der Erdkrume bilden sich mit der Bodenverwitterung durch zunehmende Herauslösung von Silikaten Horizonte, die unterschiedlich mächtig sein können. In der letzten Phase treten besonders harte Schichten aufgrund von zurückbleibenden eisen- und aluminiumoxidischen Bodenbestandteilen auf. Beispiele für solche Horizonte sind:
Fersialit
Weniger stark verwitterte Tonmineralien. Sie enthalten noch die Elemente Fe, Si und Al
(daher die Bezeichnung).
Feralit, Latosole
Blauer bis gelbbrauner tonartiger Boden aus Si-armen Mineralien. Dieser ist sehr sauer und
schwer. Man beobachtet kaum Wurzelwachstum in und durch diese Schicht.
Laterit
Ziegelartige, völlig unfruchtbare Oxidakkumulite, mächtige rote Bänke von Eisenoxid und
Aluminiumoxid als Endprodukte der Tonmineralienverwitterung (Bauxit ist hierfür ein
Beispiel). Solche Horizonte liegen typischerweise unter den Regenwäldern. Holzt man die
Wälder ab, so wird die wenige Zentimeter dicke Bodenkrume sofort abgewaschen, die
gelben Feralit- oder die roten Lateritböden treten zutage.
1.5 Stoffeintrag in Böden
Stoffeinträge erfolgen über Luft- und Wasserpfad, als Industrie- und Siedlungsabfälle und durch Land- und Forstwirtschaft.
Luftpfad
| - | Windbedingte Schwebestoffe
Hierdurch kommt es zur Bodenvermehrung und -erneuerung (Löß). |
| - | Schadgase
Hier ist die ganze Reihe von sauren Bodenzerstörern zu finden. Beispiele sind Schwefeldioxid und schweflige Säure, Chlorwasserstoff, Stickoxide, Salpetersäure und Schwefelsäure. |
| - | Schwermetalle
Beispiele sind Bleiverbindungen aus Benzin, Quecksilber und Cadmiumoxid aus MVA, Kupferverbindungen bei extensivem Weinbau. |
| - | Organische Substanzen
Dies betrifft vor allem nichtflüchtige CKW in Form von Aerosolen beim Versprühen von Pestiziden. |
Wasserpfad
Bei Überschwemmungen werden aus Flüssen mit Schwermetallen belastete Schwebestoffe
auf die Bodenoberfläche gebracht. Uferbereiche sind damit besonders angereichert. Die
Sedimentation der Schwebstoffe erfolgt auch in Häfen oder Staubecken. Das Baggergut
gehört zu hochbelasteten Problemstoffen (Rotterdam).
Industrie- und Siedlungsabfälle
1985 fielen an Müll 85 Mio. t Trockenmasse an, die entsorgt werden müssen. Die
Zusammensetzung zeigt Tabelle 2.
| Tab. 2: Prozentuale Zusammensetzung der Abfälle in Deutschland | |
| 54,0 % | Bauschutt und Bodenaushub |
| 38,0 % | Siedlungsabfälle und haushaltsähnlicher Gewerbemüll |
| 4,0 % | "Produktionsspezifische Abfälle" (Sondermüll) |
| 2,0 % | Klärschlämme |
| 1,5 % | MVA-Schlacke, Kompost (etc.) |
Dabei muss beachtet werden, dass die Kompostherstellung aus Klärschlämmen zu hohen Schadstoffbelastungen (vor allem durch Schwermetalle und nichtflüchtige CKW) führt. Weiter sind Altlasten eine Gefahr für das Grundwasser und wegen der Ausgasungen auch für die Atmosphäre.
Land- und Forstwirtschaft
| - | Abfälle
Hierbei handelt es sich zwar um Biomasse. Nachteilig ist aber, dass der Überschuss häufig genug nicht "verdaut" werden kann. So ersticken Gartenabfälle im Wald die Baumwurzeln. Mulchen kann Pilzbefall mit sich bringen. Gülle enthält stark basische Amine, die Silikate angreifen. Sie können auch mineralisiert werden und als Nitrit oder Nitrat ins Grundwasser gelangen. Grünlandumbruch hat oft die gleichen Folgen wie Überdüngung. Landwirtschaftliche Abfälle müssen deshalb genauso wie künstliche Düngung dosiert werden. Zeitpläne müssen eingehalten werden, d. h. kein Grünlandumbruch darf außerhalb der Vegetationsperiode erfolgen (etc.). |
| - | Pflanzenschutzmittel, Pestizide
49 % der deutschen Bodenfläche sind mit intensiv genutzten Kulturen bepflanzt. Diese müssen mit Pflanzenschutzmitteln vor Schädlingen oder konkurrierenden Wildkräutern geschützt werden. |
1.6 Düngung
1880 ernährte die Bewirtschaftung von 100 ha 130 Menschen, 1980 waren es bereits 460
Einwohner.
Nährstoffe für die Pflanzen sind die Hauptelemente N, P, K, Ca, Mg, S und Spurenelemente
wie Cu, Zn, Mo und B. Wegen der ständigen Entnahme von Materie beim Ernten (-> Tab.
3) reicht Wirtschaftsdünger zur Regeneration des Bodens allein nicht mehr, deshalb ist
mineralische Zusatzdüngung notwendig.
| Tab. 3: Entnahme von Mineralien bei der Ernte*) (1950) | |||||
| mittlerer Ertrag (t / ha) | Verbrauch in kg / ha | ||||
| N | K2O | P2O5 | CaO | ||
| Weizen | 2,2 Körner
5 Stroh |
60 | 40 | 25 | 12 |
| Mais | 2,2 Körner
6 Stroh |
55 | 50 | 30 | 10 |
| Kartoffel | 16 Knollen
4 Kraut |
100 | 120 | 30 | 40 |
| Zuckerrüben | 50 Wurzeln
30 Kraut |
180 | 160 | 90 | 120 |
| Kohl | 50 Kraut | 200 | 250 | 70 | 150 |
*) Die Ertragsmengen / ha sind heute um ein Vielfaches höher. Die Relation Ertrag / Verbrauch ist jedoch geblieben.
Gesetz vom Wachstumsminimum
Die Wirkung des Düngers hängt auch von der relativen Zusammensetzung ab, die auf den
Verbrauch zugeschnitten sein muss. Dies beschreibt das Liebigsche Gesetz: Derjenige
Nährstoff, der in geringster Menge da ist, bestimmt das Wachstum (-> Bild 4).
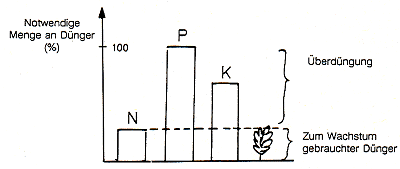
Bild 4: Gesetz vom Wachstumsminimum. Beispiel N-Mangel bei vollem P- und ausreichendem K-Angebot
Man kann das Bild aber auch anders deuten: Alles, was überschüssig gedüngt wird, ohne an Ausgewogenheit im Sinne des Liebigschen Gesetzes zu denken, wird als Ballast in den Boden gegeben und führt zum Problem der Überdüngung (-> Bild 5).
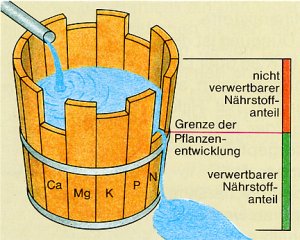
Bild 5: "Liebigsche Tonne"
(Quelle: Cornelsen)
Da der mögliche Höchstertrag durch den Stickstoff bedingt wird, wird hiermit besonders
geklotzt. Überschuss ist aber besonders gefährlich, da Stickstoff sich in den Pflanzen hoch
anreichert, unverbraucht ins Oberflächen- und Grundwasser gerät oder die Atmosphäre
belastet (NH3- und N2O-Emission).
P-Überschuss gefährdet das Oberflächenwasser (Eutrophierung).
Ernährungslage der Pflanzen
Stickstoff
Obgleich 78 % der Atmosphäre aus Stickstoff N2 bestehen, ist dieser für Pflanzen nicht ohne
weiteres verwendbar. Erst die Oxidationsstufen +5 oder 3 machen dieses Element für
Pflanzen verfügbar. Nitrat NO3- stammt aus atmosphärischen Vorgängen. Bei der
Stickstofffixierung (Leguminosen) wird Ammonium NH4+ gebildet. Bild 6 beschreibt die Bilanz
des Stickstoffs im Boden.
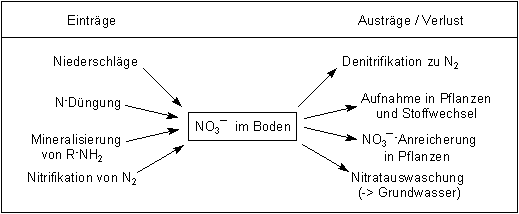
Bild 6: Nitrathaushalt im Boden
Phosphor
Obgleich Phosphat im Boden ausreichend vorhanden ist, ist es wegen sehr stabiler
Fixierung nicht sonderlich pflanzenverfügbar. Deshalb müssen leichter lösliche
Düngerphosphate gegeben werden. Da Rohphosphat bis zu 40 g Cadmium/t enthält, wird
beim Düngen viel von diesem Schwermetall eingetragen. Heute ist die P-Düngung allerdings
nur noch für 15 % des Cd-Gesamteintrags verantwortlich.
Kalium
2-5 % der Trockenmasse von Pflanzen bestehen aus Kalium, deshalb haben diese einen
besonders hohen Kaliumbedarf. Tonmineralien enthalten viel Kalium, jedoch sind von
diesem Vorrat nur 0,1-1 % verfügbar.
Natrium
Unter den Pflanzen benötigt vor allem Gras sehr viel Natrium. Das gleiche gilt für die Tiere,
die das Gras weiden. Deshalb müssen Weiden mit Natrium gedüngt werden.
Schwefel
Die Schwefeldüngung war langezeit wegen des Lufteintrags ausreichend. Es ist aber zu
erkennen, dass die S-Düngung wegen der umfassenden Rauchgasentschwefelung wieder
einsetzen muss.
Beispiele für mineralische Kunstdüngerbestandteile
| - | Ammoniumnitrat NH4NO3
Grundlage der Gewinnung ist das Haber-Bosch-Verfahren. Ein Teil des gebildeten Ammoniaks NH3 wird anschließend zur Herstellung von Salpetersäure verbrannt. |
| - | Ammoniumsulfat (NH4)2SO4
Ammoniak wird in Schwefelsäure H2SO4 geleitet. |
| - | Superphosphat Ca(H2PO4)2
/ CaSO4 · 2 H2O
Die Mischung entsteht bei partiellem Aufschluss des Minerals Phosphatit mit Schwefelsäure (Bildung von Dünnsäure). |
| - | Thomasmehl Ca-Phosphat/silicat
Dieser Phosphatdünger entsteht als Koppelprodukt bei der oxidativen Reinigung von Rohstahl, der aus sauren Eisenerzen gewonnen wird (Thomasverfahren). |
| - | Bittersalz MgSO4 · 7 H2O
Dünger für in moorigen Gebieten siedelnden Pflanzen und Nadelgehölze. |
| - | Kalisalpeter KNO3
|
| - | Kalkstickstoff CaCN2 (Calciumcyanamid)
Kalkstickstoff wird durch starkes Erhitzen von Calciumcarbid in Stickstoff hergestellt. Es handelt sich um einen Herbstdünger, der durch langsame Hydrolyse zunächst Harnstoff bildet. Letzterer wird durch die Urease von Bodenbakterien zu Ammonium und Hydrogencarbonat umgesetzt. |
| - | Gruppendünger
Diese enthalten verschiedene Düngemittel. Beispiele sind Nitrophoska (Nitrat/Phosphat/Kalium) und Hakaphos (Harnstoff/Kalium/Phosphat). |
Düngung mit Klärschlamm
Klärschlamm ist biologischen Ursprungs und sollte deshalb wie ein Wirtschaftsdünger
Volldünger sein. Die Landwirtschaft (vor allem Weinbau, Obstbau) nimmt 30-40 % ab, auf
Deponien gelangen 50 %, der Rest wird in MVA sowie in Kraftwerken zur Energieumwandlung verbrannt.
Voraussetzung für die Verwertung des Klärschlamms ist eine hohe biologische
Abbauleistung des Bodens. Erfolgt diese Mineralisation nicht, so entstehen keine
pflanzenverfügbaren Stoffe. Allerdings sind Klärschlämme häufig hochbelastet durch
Schwermetalle (vor allem durch Cadmium) und durch CKW wie den polychlorierten
Biphenylen (etc.). Der weitaus größte Teil des Schwermetalleintrags auf die Felder und
damit in die Nahrungskette erfolgt deshalb heute über Klärschlämme.
1.7 Persistenz von Schadstoffen im Boden
Schadstoffe bauen sich im betroffenen Medium (Lebewesen, Atmosphäre, Hydrosphäre oder Boden) nur sehr langsam oder gar nicht ab. Deren Stabilität wird durch die Persistenz oder die umweltchemische Verfügbarkeit beschrieben.
Die Persistenz im Boden hängt von Stoffart, Anfangskonzentration, pH-Wert, Temperatur, Adsorption, Durchlüftung und Sauerstoffgehalt sowie von der chemischen sowie biologischen Abbauaktivität ab. Um das Gefährdungspotential abzuschätzen, muss auch die biologische Persistenz, d. h. der tatsächliche Zeitraum der Aktivität die Toxizität des Stoffes gegen Lebewesen mit einkalkuliert werden. Hierbei ist noch zu beachten, an welchen Organismen die Untersuchung vorgenommen worden ist. Im Folgenden werden einige Beispiele eingehender besprochen.
Schwermetalle
Wie viel an Schwermetallverbindungen im Boden adsorbiert wird oder wandert, hängt vom
pH-Wert des Regenwassers ab. Hier liegt wahrscheinlich auch ein Wirkungsfaktor des
sauren Regens: Cadmium und andere Schwermetalle
werden als lösliche Sulfate, Chloride oder Nitrate mobilisiert.
Kupfer
Da Kupfer antibakteriell und antimykotisch wirkt, wird es bei der Bekämpfung von Pilzen im
Weinbau (Mehltau) in teilweise recht hohen Mengen eingesetzt. Das Schwermetall ist
niedrig persistent. Es häuft sich wegen der guten Löslichkeit seiner Verbindungen kaum im
Boden an und ist auch nur mäßig giftig. Es ist sogar ein unverzichtbares Spurenelement. Ab
Konzentrationen unter 4 mg/kg Boden beobachtet man bei Pflanzen Cu-Mangel. Pflanzen
entziehen dem Boden pro Ernte 30-100 g/ha.
Quecksilber
Quecksilber wird zwischen Boden und Grundwasser sowie Atmosphäre rasch ausgetauscht,
zeigt also geringe Bodenpersistenz. Wegen der Giftigkeit seiner Verbindungen und wegen
der Akkumulation im Gewebe ist es aber biologisch hoch persistent.
Zink
Die Giftigkeit von Zink wirkt sich erst ab 300 mg/kg Boden aus. Ähnlich wie Cu wird auch
dieses Schwermetall leicht ausgewaschen. Es ist ebenfalls ein wichtiges Spurenelement mit
geringer biologischer Persistenz.
Blei
Bleiverbindungen wie Sulfat und Chlorid
sind im Boden sehr unbeweglich und reichern sich
deshalb an. Neben vielbefahrenen Straßen findet man Konzentrationen von mehr als 700
mg/kg Boden. Die Bodenpersistenz ist also sehr hoch. Da es aber mäßig giftig ist, ist die
biologische Persistenz niedriger.
Cadmium
Ein Cadmiumgehalt von 0,1-1 mg/kg Boden ist natürlich. Ab 20-50 mg/kg wirkt
Cadmium
pflanzentoxisch. Es ist also biologisch hoch persistent. Allerdings gilt dies nicht für einige
Pilze, obwohl sie Cadmium geradezu speichern, ohne vergiftet zu werden.
Die Persistenz im Boden hängt auch von Wechselwirkungen zwischen Boden/Wasser ab.
Auch hierzu gibt es eine Reihe von guten Beispielen.
Nitrat
Wegen der guten Wasserlöslichkeit ist Nitrat nicht bodenpersistent, kontaminiert aber in
hohem Maße das Grundwasser. Hier reichert es sich an. Der natürliche Grenzwert wird
unter Wald oder Grünland gemessen. Er beträgt 25 mg/l.
Mineralöle
Das Rückhaltevermögen des Bodens ist 5-10 l Öl /m3 Boden. Öl kann nur schwer
ausgewaschen werden, da es sich mit Wasser kaum mischt. Dabei wirkt sich das geringe
spezifische Gewicht (0,75 g/ml) günstig aus. Auch in Wasser ist die Persistenz recht hoch,
da 1 l Öl ca. eine Mio. Liter Wasser verunreinigen können. Diese hohe Persistenz wird
durch einen guten mikrobiellen Abbau relativiert, wobei allerdings ausreichend Sauerstoff
zugegen sein muss.
Chlorierte Kohlenwasserstoffe (CKW)
Das Rückhaltevermögen bei Sand und Kies beträgt 10 l CKW /m3 Boden, allerdings 20 l bei
Grundwasserleitern (Tonschichten). Das hohe spezifische Gewicht (1,3 g/ml) bewirkt, dass
sich die CKW wie eine Fahne an der Grundwassersohle ausbreiten. Sie gehen allmählich
in Lösung, da sie sich in Spuren mit Wasser mischen. Wegen fehlendem mikrobiellen
Abbaus bleibt nur adsorptive Abtrennung mit Aktivkohlefiltern, wie sie bei der
Trinkwasseraufbereitung schon üblich ist.