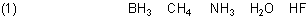
Ist Methan eine Säure? Zur Elektronegativität des Kohlenstoffs
Die Antwort lautet: Ja und Nein...
Säuren sind nach Brönsted Protonendonatoren. Methan gehört nicht dazu. Aber man muss da schon etwas differenzieren.
Die Hydride der Nichtmetalle der zweiten Reihe im PSE
Wir wollen das anhand der Hydride der Nichtmetalle der zweiten Reihe im PSE erklären
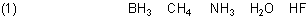
Wie sieht es mit deren Säure/Base-Eigenschaften aus?
Das können wir anhand der Elektronegativität (EN) herleiten. Die EN ist ein Maß dafür, inwieweit Elemente in einer Bindung Elektronen vom anderen Bindungspartner zu sich herüberziehen können. In diesem Fall vergleichen wir die o. a. Elemente mit Wasserstoff.
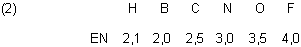
| - | Im Borhydrid (Boran) ist in der B-H-Bindung das Boratom ein wenig positiv polarisiert, der Wasserstoff negativ. |
| - | Beim Methan ist das C-Atom schwach negativ polarisiert; die Polarität der C-H-Bindungen ist jedoch äußerst gering. |
| - | Im Ammoniak-Molekül sind die Elektronen der N-H-Bindungen schon eher zum Stickstoffatom gezogen, so dass Ammoniak unter bestimmten Bedingungen wie eine Säure wirkt, also Anionen bilden kann (wie das Amid-Ion NH2-). Ansonsten ist Ammoniak eher eine Base. |
| - | Im Wasser-Molekül ist die Polarität der O-H-Bindung bereits so ausgeprägt, dass Wasser auch unter normalen Umständen zugleich als Base und Säure wirkt (Wasser ist somit ein typischerer Ampholyt als Ammoniak). |
| - | Fluorwasserstoff ist bereits eine Säure, dessen Protonen leicht abdissoziieren. |
Zur EN der Kohlenwasserstoffe
Alkane reagieren wie das Methan, nämlich gar nicht, das heißt, ihre Wasserstoffatome lassen sich nicht als Protonen
abspalten. (Ausgenommen sind natürlich extreme Reaktionsbedingungen wie Hitze, Strahlungseinwirkung und so weiter.) Das
Ethin bildet sogar schon Salze (Carbide), allerdings sind ihre Anionen C22- in wässrigem Milieu nicht
stabil. Offenbar ist die EN keine absolute Größe, sondern hängt vom Bindungsgrad des Kohlenstoffs ab.
Man muss deshalb die gesättigten von den ungesättigten Kohlenwasserstoffen unterscheiden. Zunächst betrachten wir die C-H-Bindungslängen.

Es kommt zur zunehmenden Abstoßung der beiden Atomkerne, was zur Bindungslockerung führt.
Das hat Auswirkungen auf Elektronegativitäten der jeweiligen Kohlenstoffatome. Offenbar nimmt die EN mit dem Bindungsgrad zu:
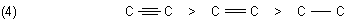
Man kann auch sagen: Der EN-Wert sinkt mit dem Hybridisierungsgrad.
Bei den Aromaten kommt als EN-verstärkend noch die Mesomerie hinzu. Deshalb können aromatische
Kohlenwasserstoffe bei bestimmten Reaktionen Protonen abgeben. Das ist besonders bei Substitutionen der Fall.
Klicke zum Beispiel hier.
Was sind CH-acide Verbindungen?
Es gibt aber durchaus organische Verbindungen, bei denen die Bindung zwischen C und H unter Bildung von H+-Ionen
leicht gelöst werden kann. Das sind solche Verbindungen, bei denen aufgrund der Nachbarschaft von Gruppen mit
(-I)-Effekt ein starker Elektronenzug von der C-H-Bindung weg besteht. Man spricht von CH-aciden Verbindungen.
Sie enthalten meistens eine aktive Methylengruppe.
Ein bekanntes Beispiel ist der Malonsäure-diethylester (Malonester), von dem es sogar Natrium-Salze zu kaufen gibt. Die sind allerdings nur in nichtwässrigen Lösemitteln stabil.
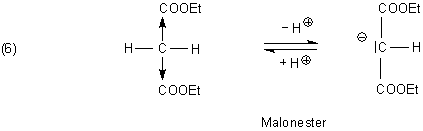
Der Malonester spielt eine wichtige Rolle in der organisch-chemischen Synthese - zum Beispiel zur Herstellung von Zimtsäure.
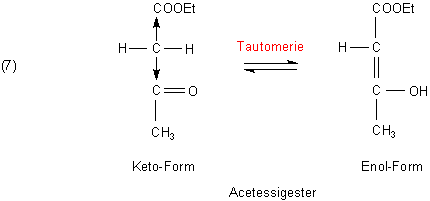
Das gilt auch für den Acetessigsäureethylester, kurz Acetessigester. Der verfügt ebenfalls über eine CH-acide Methylengruppe. Typisch für den Acetessigester ist das Keto-Enol-Gleichgewicht (Tautomerie).
Weitere Texte zum Thema „Kohlenwasserstoffe“