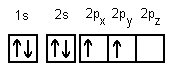
Vom Grundzustand zum angeregten Zustand
Zum genaueren Verständnis des Bindungsverhaltens eines Kohlenstoffatoms im Kohlenwasserstoffmolekül ist eine Betrachtung der Elektronenaufenthaltswahrscheinlichkeitsräume (Orbitale) hilfreich.
Kohlenstoff besitzt die Elektronengrundkonfiguration 1s2 2s2 2p2. Die vier potentiellen Bindungselektronen befinden sich nach dem Pauli-Prinzip spingepaart im vollbesetzten 2s-Orbital und mit parallelem Spin ungepaart (Hundsche Regel) in zweien der drei besetzbaren und energetisch gleichwertigen p-Orbitale.
In der gebräuchlichen Kastenschreibweise, in der man die einzelnen Elektronen unter Berücksichtigung ihres Spins als Pfeile darstellt, ergibt sich für ein Kohlenstoffatom im Grundzustand also folgendes Bild:
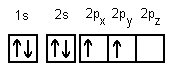
Die Orbitale haben folgende Form:
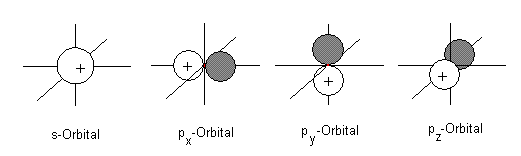
Natürlich muss man sich diese überlagert um den Kern des Kohlenstoffatoms herum vorstellen.
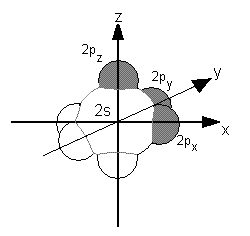
Elektronen in s-Orbitalen einer Schale haben hierbei niedrigere Energien als Elektronen in p-Orbitalen:
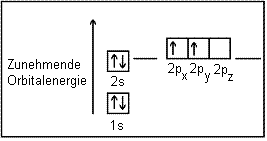
Im Kohlenstoffatom des Grundzustandes würden also nur die zwei ungepaarten Elektronen des p-Orbitals als Valenzelektronen zur Verfügung stehen. Kohlenstoff tritt in seinen Verbindungen jedoch immer vierbindig auf, was man am Beispiel des Methans CH4 erkennen kann.
Damit könnte man annehmen, dass unter Berücksichtigung der Hundschen Regel ein Elektron des s-Orbitals auf das Niveau eines p-Orbital-Elektrons gehoben wird, was jedoch zwei verschiedene "Arten" von Valenzelektronen zur Bindung bereitstellen würde. Dieses hypothetische Gedankenmodell zeigt die folgende Darstellung:
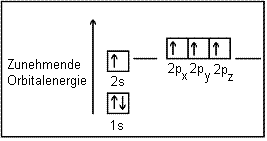
Da für die Anhebung eines Elektrons aus dem s- in das p-Orbital eine Energie von etwa 400 kJ/mol benötigt wird, das Atom also eine höhere Energie als in seinem Grundzustand besitzt, spricht man von dem "angeregten Zustand" des Kohlenstoffatoms.
Jetzt würden dem Kohlenstoffatom zwar vier Bindungselektronen zur Verfügung stehen. Diese Bindungen würden
sich jedoch energetisch und in ihrem Überlappungsgrad der Orbitale, also ihrer Bindungslänge zu anderen Atomen
in Molekülen, unterscheiden.
In einem Methanmolekül könnte man also mit vier Wasserstoffatomen (+ 4 H)
folgende Bindungsorbitale finden:
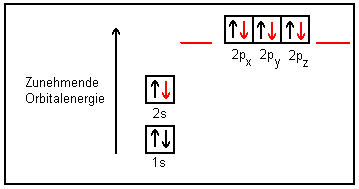
Das heißt nichts anderes, als dass man zwei verschiedene C-H-Bindungen erwarten müsste. Das widerspricht völlig der chemischen Erfahrung. Letztlich aber haben spektroskopische Messungen ergeben, dass die Abstände zwischen dem Kohlenstoffatom und den vier kovalent gebundenen Wasserstoffatomen im Methan gleich lang sind und damit auch als energetisch gleichwertig betrachtet werden müssen. Wie passen diese Ergebnisse nun zu den Aussagen des Orbitalmodells?
Die Antwort liegt in der Bildung von "Mischorbitalen" in Molekülen aus dem angeregten Zustand des Kohlenstoffatoms heraus. Diese Orbitale werden Hybridorbitale genannt.
Weitere Texte zum Thema „Kohlenwasserstoffe“