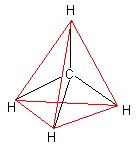
sp3-Hybridisierung: Warum ist das Methanmolekül ein Tetraeder?
Die Vierbindigkeit des Kohlenstoffatoms beruht auf einem Vorgang, den man Hybridisierung nennt. Dieses lässt sich schön an dem einfach gebauten, tetraedrischen Methanmolekül veranschaulichen.

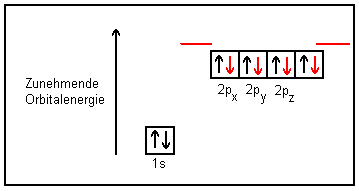
Bei der Molekülbildung des Methans aus seinen Elementen wird eines der beiden 2s-Elektronen durch Energiezufuhr in das unbesetzte 2p-Orbital-Niveau gehoben, wodurch sich nun vier Einzelelektronen ungepaart in vier einzelnen Orbitalen befinden. Die für diesen Vorgang benötigte Energie von etwa 400 kJ/mol wird durch die bei der Bindung mit vier Wasserstoffatomen frei werdende Energie überkompensiert. Nun kommt es zu einer Mischung des einzelnen s-Orbitals mit allen drei p-Orbitalen, was zu vier gleichwertigen Mischorbitalen führt.
Diese vier neuen "Mischorbitale" werden als sp3-Hybrid-Orbitale bezeichnet, da sie aus einem s- und drei p-Orbitalen gebildet werden. Eigentlich müsste man also s1p3-Orbital schreiben. Jedes von ihnen beschreibt den Aufenthaltsraum eines einzelnen Valenzelektrons des Kohlenstoffatoms. Als Schnitt durch die Orbitale dargestellt, ergibt sich für die Kombination des s-Orbitals mit einem der p-Orbitale folgendes Bild:
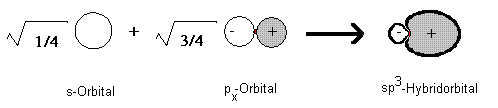
Solche Diagramme kann man selbst erstellen. Hier ist die Vorschrift: Anleitung zur graphischen Kombination von Orbitalen.
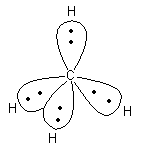
Im Raum nehmen die vier sp3-Hybridorbitale aufgrund der Elektronenladungen den größtmöglichen Abstand voneinander ein. Das kann man anhand von vier gleichgroßen Luftballons zeigen. Die vier sp3-Orbitale zeigen auf die Eckpunkte eines Tetraeders und stehen somit in einem Winkel von 109,5° zueinander. In der Mitte des Tetraeders befindet sich das Kohlenstoffatom.

(Foto: Andreas)
Weitere Texte zum Thema „Kohlenwasserstoffe“