Anleitung zur graphischen Kombination von Orbitalen
Die Entstehung von Hybridorbitalen kann als eine Addition von Räumen betrachtet werden. Dieses wollen wir anhand der Bildung eines Hybridmolekülorbitals, das sich aus s-Orbital und p-Orbital zusammensetzt, auf einfachem, mathematischem Wege durchführen. Alles was man dafür benötigt, sind Millimeterpapier, Farbstifte und etwas Zeit.
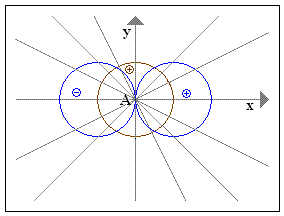
Wir vereinfachen das Ganze, indem wir annehmen, dass die Orbitale aus gleichgroßen Kreisen bestehen. (Mathematisch gesehen ist das p-Orbital ansonsten eine Lemniskate.) Außerdem gehen wir nicht räumlich vor, sondern beschränken uns auf die zweidimensionale Darstellung. Das Prinzip der Addition der beiden Räume beruht auf einer Vektoraddition.
Als erstes zeichnet man in ein rechtwinkliges Koordinatensystem ein kreisförmiges s-Orbital und ein hantelförmiges p-Orbital:

Im Zentrum A steht der Atomkern. Das (+) im p-Orbital bedeutet, dass sich das Elektron auf dieser Seite der Hantel bevorzugt aufhält. Im Raum mit dem (-)-Zeichen ist die Wahrscheinlichkeit dagegen gering.
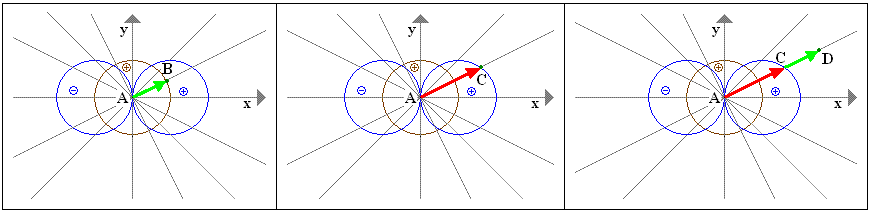
Zunächst zeichnen wir Strahlen ein, an denen wir unsere Vektoren ausrichten.
Im Bereich des gemeinsamen (+)-Vorzeichens von s-Orbital und p-Orbital (hier die rechte Seite im Koordinatensystem)
werden die Vektoren addiert. Der Raum, in dem sich das Elektron bewegen kann, vergrößert sich.
AB + AC = AD
 |
||
| Vektor AB für das s-Orbital | Vektor AC für das p-Orbital | Addition: AB+AC=AD |
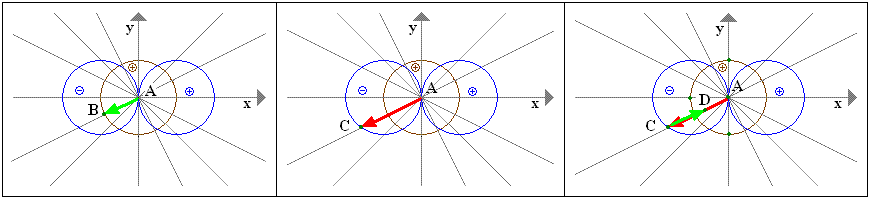
Im Bereich des negativen Vorzeichens des p-Orbitals muss man den Vektor AC (p-Orbital) vom Vektor AB (s-Orbital) subtrahieren:
AB - AC = AD
Der Raum, in dem sich das Elektron sowieso kaum aufhält, verkleinert sich noch.
 |
||
| Vektor AB für das s-Orbital | Vektor AC für das p-Orbital | Subtraktion: AB-AC=AD |
Führt man dieses Verfahren der Vektoraddition nun in einer großen Anzahl auf den Hilfsgeraden durch und verbindet man die einzelnen Punkte, so erhält man folgendes Bild:
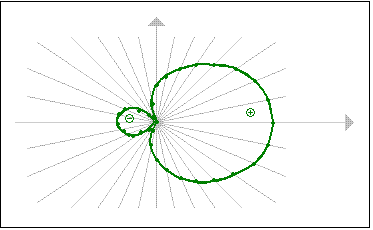 |
| Fertig ist das Hybridorbital! |
Auf dem Papier, von Hand gezeichnet, sieht das Ganze dann so aus:
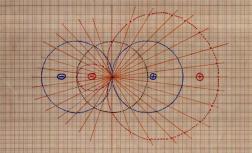
Durch den Vergleich des so erstellten Hybridorbitals mit einem einfachen p-Orbital kann man gut erkennen, wie durch die weit ausladenden Hybridorbitale stärkere Bindungen mit anderen Atomorbitalen ausgebildet werden können. Denn sowohl der Grad als auch die Möglichkeit der Überlappung durch die vergrößerten Elektronenräume im Vergleich zum einfachen p-Orbital nimmt stark zu. Damit wird auch die Abstoßung der positiv geladenen Atomkerne der Bindungspartner verringert.
Weitere Texte zum Thema „Kohlenwasserstoffe“