Für Spezialisten: Beschreibung chiraler Moleküle nach Cahn-Ingold-Prelog
Bild und Spiegelbild eines Moleküls sind chirale Stereoisomere und werden auch als Enantiomere bezeichnet. Ein einfaches Beispiel für ein chirales Kohlenwasserstoffmolekül ist 3-Methylhexan.

Das mit dem Stern markierte Kohlenstoffatom ist wie alle anderen C-Atome in diesem Molekül sp3-hybridisiert und stellt durch seine vier unterschiedlichen Reste ein Chiralitätszentrum dar. Man spricht auch von einem asymmetrischen C-Atom.
Das erkennt man besonders gut, wenn man sich um das asymmetrische C-Atom einen Tetraeder denkt, in dessen Ecken die vier Substituenten ragen. Dann sieht man, dass man zwei Tetraeder konstruieren kann, die sich wie Bild und Spiegelbild verhalten. Sie sind "händig", also chiral.
Bislang hat man die Moleküle durch den Drehsinn der Schwingungsebene von polarisiertem Licht charakterisiert: (+) oder (-). Dann kam die absolute Konfiguration hinzu: D bzw L. D steht für lat. dextra = rechts, L für laevus = links. (Früher wurden die beiden Buchstaben kleingeschrieben.) Damit beschreibt man, wie sich die vier verschiedenen Substituenten um das C-Atom anordnen - verglichen mit den zwei Glycerinaldehydformen, deren absolute Konfiguration man aufklären konnte.
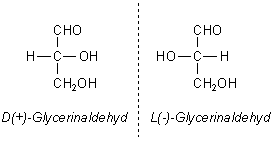
Wichtig: Die Drehrichtung des Lichtvektors hat nichts mit den D- oder L-Formen zu tun.
Diese Beschreibung reichte aber noch nicht aus. Vor allem war das Bezugssystem etwas unhandlich. Deshalb entschlossen sich Cahn, Ingold und Prelog 1966, zu einer allgemein akzeptierbaren Nomenklatur. Die wollen wir hier am Beispiel der optisch aktiven Kohlenwasserstoffe erklären.
So funktioniert es
Man dreht das Molekül so, dass der Substituent mit der niedrigsten Masse (hier das H-Atom) hinter
der Papierebene steht, das *C-Atom dagegen in ihr und die drei anderen Substituenten
vor ihr stehen. Das sind in unserem Beispiel Methyl-, Ethyl- und Propyl-Rest.
Diese drei Substituenten werden entsprechend ihrer Priorität gewertet. Je höher die Ordnungszahl im
PSE des ersten Atoms des Substituenten ist, desto höher ist seine Priorität. Sind diese wie im gewählten
Beispiel gleichwertig, weil es sich nur um C-Atome handelt, entscheidet die Priorität des in der Kette
nächstgebundenen Atoms.
Die Prioritäten nehmen deshalb in folgender Reihe ab: Propyl-, Ethyl- und Methylrest.
Wenn man die drei Substituenten nun nach absteigender Priorität ordnet, ergibt sich ein Drehsinn, der mit oder gegen den Uhrzeigersinn verlaufen kann.
Ein Molekül, dessen Substituenten in ihrer Priorität mit dem Uhrzeigersinn abnehmen, wird als (R)-Form (R = lat. rectus = rechts) bezeichnet.
Ein Molekül, dessen Substituenten in ihrer Priorität gegen den Uhrzeigersinn abnehmen, wird als (S)-Form (S = lat. sinister = links) bezeichnet.
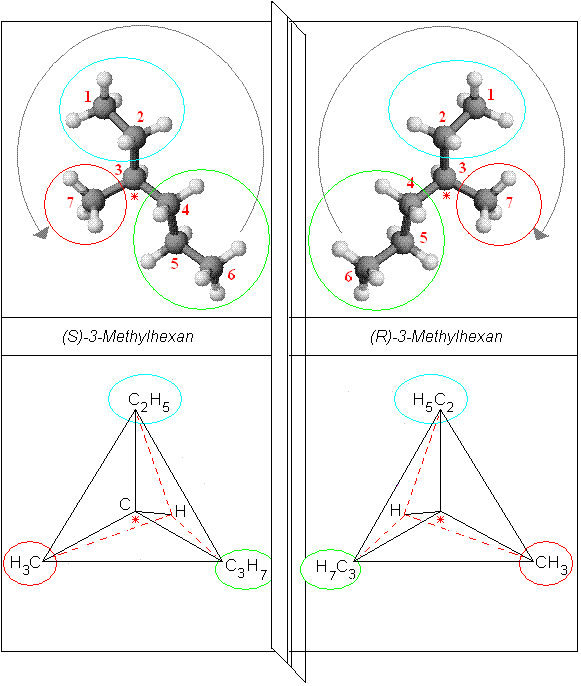
Hierzu gibt es eine nette "Eselsbrücke": Man stellt sich den die Prioritäten ordnenden Kreisvektor als Lenkrad eines Autos vor. Eine gelenkte Linkskurve beschreibt die linksdrehende (S)-Form, eine Rechtskurve die rechtsdrehende (R)-Form.
Schauen wir uns noch einmal den Glycerinaldehyd an. Seine Prioritätenliste sieht so aus: OH, CHO, CH2OH und H.
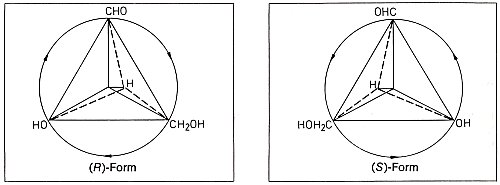
Beim Glycerinaldehyd sind somit die D- und R-Form sowie die L- und S-Form identisch.
Warum ist das Phänomen der Stereoisomerie dann überhaupt von Bedeutung?
Hierzu einige wenige Beispiele aus der Biochemie: Bild und nicht identisches Spiegelbild eines Moleküls
weisen oft unterschiedliche physiologische Wirkung auf. So wird die (S)-Form des Asparagins vom menschlichen
Geschmack als bitter empfunden, die (R)-Form jedoch als süß. (S)-Limonen wird als Zitronenaroma wahrgenommen.
(R)-Limonen riecht nach Orangen. Traurige Berühmtheit erlangte das Contergan, das in seiner (R)-Form ungefährlich
für werdende Mütter war, in seiner (S)-Form jedoch starke Missbildungen am ungeborenen Kind verursachen konnte.
Das liegt daran, dass biologisch aktive Moleküle wie die Enzyme oder Rezeptoren selbst chiral sind. Sie können nur bei passender Form (Modell von Schloss-Schlüssel) wechselwirken. Diese Verbindungen aus Enantiomeren heißen Diastereomere. Anders als die beiden enantiomeren Formen sind sie chemisch und physikalisch vollständig verschieden.
Weitere Texte zum Thema „Kohlenwasserstoffe“