Cycloalkane - Ringspannung und Bananenbindung
Im Erdöl sind neben den n-Alkanen und den verzweigten Alkanen auch ringförmige Kohlenwasserstoffe, die Cycloalkane, enthalten. Da sie durch die Ringbildung zwei Wasserstoffatome weniger haben, ist ihre Allgemeinformel
CnH2n
In der Ringstruktur ist die freie Drehbarkeit um die C-C-Bindungen aufgehoben - die Bindungen sind starr. Wie sehen solche Ringmoleküle bei Alkanen aber nun genau aus? Die C-Atome sind auch bei den Cycloalkanen sp3-hybridisiert. Der Tetraederwinkel von 109,5° im linearen Kohlenwasserstoffgerüst scheint doch die Möglichkeiten für Ringschlüsse sehr einzuschränken. Tatsächlich ist jedoch ab drei Kohlenstoffatomen ein Ringschluss möglich.
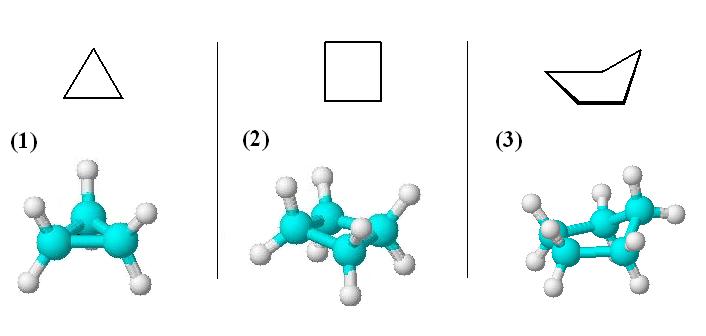
Das folgende Bild zeigt die ersten drei Cycloalkane: Cyclopropan (1), Cyclobutan (2) und Cyclopentan (3).

Cyclopropan bildet ein Dreieck mit einem Winkel von 180° / 3 = 60° zwischen den C-C-Atomen. Davon müssen wir die Stellung der sp3-Orbitale, die die C-C-Bindungen ausbilden, unterscheiden. Ihr Winkel beträgt statt 109,5° im normalen sp3-Tetraeder nur 101°.
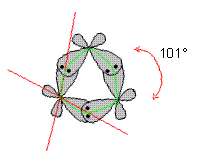
Durch diesen erzwungenen Winkel können die sp3-Hybridorbitale weniger gut überlappen. Dies verursacht eine beträchtliche Instabilität ("Spannung") des Ringes. Das hat, verglichen mit offenkettigen Analogen, eine viel größere Verbrennungswärme zur Folge. Da man die drei C-C-Bindungen im Cyclopropan als gebogen betrachten muss, wird im Englischen diese Bindung "banana-bond" genannt - ein schönes Beispiel für die ansprechende Bildhaftigkeit der englischen Naturwissenschaftssprache.
Hinzu kommt, dass in der Ringstruktur des Cyclopropans die Wasserstoffmoleküle in die ungünstige verdeckte Konformation gedrückt werden, was ebenfalls zur Ringspannung beiträgt.
Im Cyclobutan (C4H8) beträgt der Bindungswinkel bereits 90°. Aufgrund der Abstoßung der gebundenen Wasserstoffatome stehen die C-Atome des Ringes jedoch nicht mehr in einer Ebene, sondern leicht verdreht zueinander.
In der Ringstruktur vom Cyclopentan (C5H10) würde man einen Winkel von 108° erwarten, was dem optimalen Tetraederwinkel schon ziemlich nah käme. Überraschenderweise stellt sich hier jedoch ein Kohlenstoffatom des Ringes außerhalb der Ebene, um wiederum die H-H-Wechselwirkungen zu verringern. Somit gleicht das Ringmolekül in dieser Form einem Briefumschlag, wie man auf dem Bild erkennen kann.
Erst der Ring des Cyclohexans ist frei von jeglichen Spannungen.
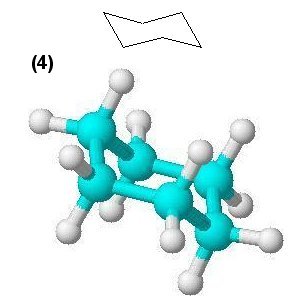
Die Strukturen dieses Kohlenwasserstoffmoleküls sind so interessant, dass wir ihnen eine eigene Webseite gewidmet haben: Cyclohexan - Sessel und Wanne.
Weitere Texte zum Thema „Kohlenwasserstoffe“