
Die sp2-Hybridisierung (C=C-Doppelbindung und π-Elektronen)
Alkene sind ungesättigte Kohlenwasserstoffe. Ungesättigt bedeutet, dass nicht alle Kohlenstoffatome mit der maximalen Anzahl an Wasserstoffatomen gebunden sind. Deshalb haben diese C-Atome jeweils ein Elektron über. Folglich gehen benachbarte Kohlenstoffatome im Molekül Doppelbindungen miteinander ein, an denen jeweils vier Bindungselektronen beteiligt sind (klicke hier).

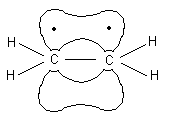
Kalottenmodell von Ethen
(Foto: Daggi)
Zunächst bildet sich eine C-C-Bindung unter Beteiligung zweier Hybridorbitale aus. Dann gibt
es aber eine Schwierigkeit: Bei einer C-C-Bindung über eines der vier sp3-Hybridorbitale
des Kohlenstoffs wären drei Orbitale viel zu weit von einander entfernt, als dass sie die zweite
C-C-Bindung durch Überlappung eingehen könnten. Erinnern wir uns an das Luftballonmodell
beim Methan! Aber waren da nicht die Cycloalkane mit ihren gering ausgeprägten
sp3-Orbital-Überlappungen? Sogar das Molekül Cyclopropan mit seinen wenig überlappenden
sp3-Orbitalen hielt - wenn auch nicht gerade besonders gut. Aber hier ist des Guten zuviel:
Ein Alken aus sp3-Hybridorbitalen würde nicht halten.
Deshalb kann sich mindestens ein Elektron nicht im sp3-Hybridorbital-System befinden,
sondern muss draußen vor bleiben. Das ist ein sowieso schon weiter ausladendes 2p-Orbital. Es ist
aber nicht weit ausladend wie ein sp3-Orbital. Folglich müssen die Atomkerne der beiden
C-Atome näher zueinander kommen. Sie stoßen sich deshalb eher ab - was zu einer gewissen Instabilität
der C-C-Doppelbindung und einer höheren Reaktivität der Alkene (verglichen mit den Alkanen) führt.
Die Doppelbindung eines Alkens besteht aus zwei verschiedenen
Bindungsarten
An der Hybridisierung sind dann auch nur das 2s-und zwei der drei 2p-Atomorbitale beteiligt. Man
spricht deshalb von einer sp2-Hybridisierung. (Eigentlich müsste man s1p2-Orbital
schreiben.)
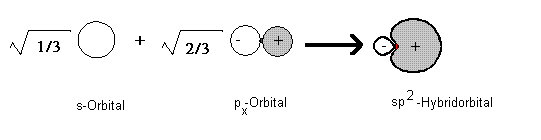
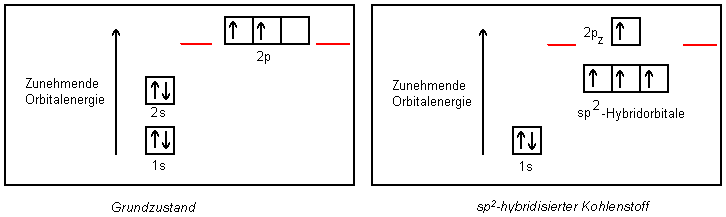
Es entstehen dadurch drei identische Hybridorbitale. Erinnern wir uns: Bei den sp3-Orbitalen ragen die vier Orbitale in die Ecken eines Tetraeders. Die drei sp2-Hybridorbitale sind dagegen trigonal-planar in einer Ebene angeordnet und stehen in einem Winkel von 120° zueinander.
Diese Hybridorbitale bilden mit ihrem jeweiligen Bindungspartner (C oder H) durch Überlappung eine σ-Bindung, die Elektronen heißen σ-Elektronen.
Die an der π-Bindung beteiligten Elektronen bezeichnet man als π-Elektronen. Die Bindungen der pz-Orbitale sind schwächer als die σ-Bindungen, da sie weniger gut überlappen. Damit sind π-Bindungen auch erheblich weniger stabil, können also leichter aufgespalten werden, was die Alkene weitaus reaktionsfähiger als Alkane macht. Sie sind auch durch weniger energiereiche elektromagnetische Strahlung leichter anregbar als die σ-Elektronen.
Die wichtigsten Reaktionen, die an diesem "Reaktionszentrum" der Alkene ablaufen können, findet man auf der Webseite Reaktionen an der Doppelbindung.
Die sp2-Hybridisierung gilt auch gegenüber anderen Bindungspartnern wie den Wasserstoffatomen. Die C-H-Bindungsabstände sind deshalb bei den Alkenen ebenfalls kürzer als die im Methan.
Weitere Texte zum Thema „Kohlenwasserstoffe“