Wann ist eine Verbindung ein Aromat?
Es ist oftmals bei der Betrachtung einer Strukturformel gar nicht so einfach zu entscheiden, ob es sich bei dem Molekül um einen Aromaten oder eine andere Verbindung handelt.
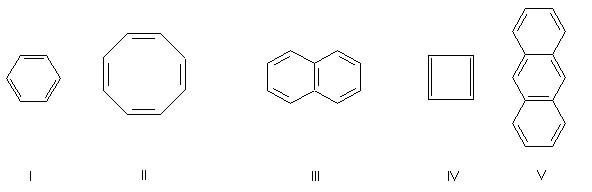
Handelt es sich bei folgenden Molekülen um Aromaten?

Zum Glück gibt es einige Regeln, über die ein aromatisches Molekül eindeutig als solches zu erkennen ist.
Erkennungskriterien von Aromaten
Die Hückel-Regel
Die Hückel-Regel besagt, dass eine ungesättigte, ringförmige Substanz nur dann ein Aromat ist,
wenn für die Zahl der π-Elektronen in ihrem konjugierten Ringsystem folgende Beziehung gilt.
(4n + 2) π-Elektronen mit n = 0, 1, 2, 3,...
Das Symbol n ist eine positive, ganze Laufzahl. (n ist übrigens nicht die Zahl der Ringe! Darauf wird gern geschlossen, weil dies ausgerechnet bei Benzol, Naphthalin und Anthracen zutrifft.)
Ein Beispiel für n = 0 ist eine exotische Verbindung, das Cyclopropenylium-Kation.
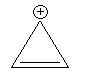
Hier ist kein System von konjugierten Doppelbindungen vorhanden. Die Hückel-Regel gilt aber für n = 0; dann ist nämlich 4 x 0 + 2 = 2. Diese zwei π-Elektronen sind tatsächlich im Ring delokalisiert. Damit ist das Cyclopropenylium-Kation ein Aromat.
Aromaten sind also planare carbocyclische Verbindungen mit 2, 6, 10, 14, 18 (usw.) π-Elektronen im Ring. Nur diese können mesomeriestabilisiert sein.
Was ist ein Antiaromat?
Eine carbocyclische Verbindung mit einer geraden Anzahl an π-Elektronenpaaren nennt man Antiaromat.
Solche Verbindungen entsprechen nicht der Hückel-Regel. Antiaromaten können, müssen aber nicht planar sein.
Ein Beispiel ist das Cyclobutadien.

Sein Molekül ist zwar planar gebaut, seine Doppelbindungen sind konjugiert. Das spricht für das Vorliegen eines
Aromaten.
Die Zahl seiner π-Elektronen beträgt 4. Wenden wir also die Hückel-Regel an. Ist das möglich: (4n + 2) => 4?
Nein. Es gibt somit keine Zahl n, für die, wenn man sie in die Hückel-Formel einsetzt, 4 herauskäme!
Cyclobutadien ist tatsächlich kein Aromat. Denn die Doppelbindungen im Ring sind fest fixiert. Man muss
sogar Energie hineinstecken, damit diese ihre Position im Ring wechseln. Letztlich ist Cyclobutadien ein Alken
- genau ein Alk-dien.
Pseudo- oder Quasiaromaten
Viele denken, dass der Begriff der Aromatizität nur die Organische Chemie betrifft. Es gibt jedoch auch in der Anorganischen
Chemie Beispiele für aromatische Verbindungen, die auch ohne das Element Kohlenstoff auskommen.
Ein bekanntes Beispiel ist das Schwefel-Kation S42+. Es hat 6 delokalisierte Elektronen. Es erfüllt damit formal die Hückel-4n+2-Regel und ist damit als aromatisch zu bezeichnen. Um "klassische" (also organische) Aromaten wie das Benzol von den anorganischen zu unterscheiden, hat man die Begriffe pseudo- oder quasiaromatisch eingeführt.
Hier sind zwei wichtige Grenzstrukturen der mesomeren Zustände des Schwefel-Kations.
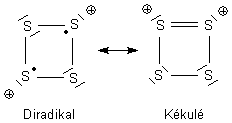
Es gibt noch eine weniger wahrscheinliche co-ionische Struktur, bei der ein S-Atom zwei positive Ladungen trägt.
Literatur:
Ralf Alsfasser, H. J. Meyer: Moderne Anorganische Chemie, de Gruyter, 2007
Mit diesen Informationen ausgestattet können wir uns die obigen Stoff-Beispiele
genauer betrachten
Wie alle Regeln in der Chemie hat auch diese Regel ihre Grenzen
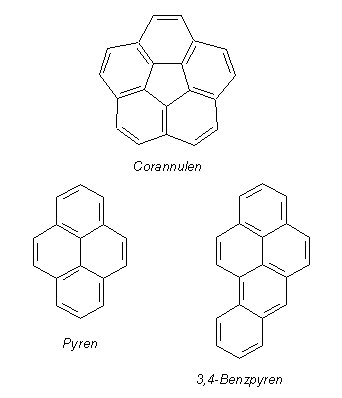
Will man z. B. klären, ob Corannulen oder Pyren
bzw. 3,4-Benzpyren Aromaten sind, so sind die o. a. formulierten Erkennungskriterien nicht besonders hilfreich.
Pyren hat 16 π-Elektronen. Corannulen und Benzpyren haben die π-Elektronenzahl 20, also 10 Elektronenpaare.
Die Hückel-Regel sagt "Nein". Hinzu kommt, dass Corannulen nicht einmal planar ist. Dennoch haben die drei
Verbindungen die spektroskopischen und chemischen Eigenschaften von aromatischen Verbindungen. Man nennt sie übrigens
auch polykondensierte Aromaten (PAK).
Weitere Texte zum Thema „Kohlenwasserstoffe“