
Das Adsorptionsgleichgewicht
Bei der Adsorption werden Teilchen adsorbiert und andere gleichzeitig wieder desorbiert, also freigesetzt. Man kann sich das so vorstellen, dass ein sich in Flüssigkeit oder in Gasphase befindliches Teilchen auf die Oberfläche des Feststoffes auftritt, für eine kurze Zeit festgehalten wird, sich dann wieder löst und in die flüssige bzw. Gasphase zurückkehrt. Im gleichen Moment, trifft ein anderes Teilchen auf die Oberfläche, wird gebunden (usw.). Nach einiger Zeit tritt ein Gleichgewicht ein, das Adsorptionsgleichgewicht.

Das Adsorptionsgleichgewicht liegt vor, wenn sich in einem Zeitintervall genau so viele Teilchen von der Oberfläche lösen, wie gebunden werden. Es handelt sich um ein temperaturabhängiges dynamisches Gleichgewicht.
Trägt man in einer Graphik die Stoffmenge des adsorbierten Substrats [AS] gegen die Konzentration des Substrats [S] in einer Flüssigkeit bzw. gegen den Partialdruck eines zu adsorbierenden Gases in einer Gasmischung auf, so erhält man Langmuirsche Adsorptions-Isotherme. Im folgenden Bild ist eine Isothermenschar für verschiedene Temperaturen dargestellt (daher "isotherm"). Für alle dargestellten Kurven ist die Stoffmenge des Adsorptionsmittels konstant. Man erkennt, dass mit steigender Temperatur die Adsorption abnimmt.
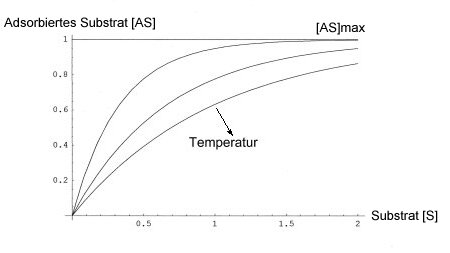
Die Kurve beginnt am Nullpunkt (wenn kein Substrat vorhanden ist, kann auch nichts adsorbiert werden) und steigt zunächst steil an. Mit zunehmender Konzentration wird die Kurve flacher und nähert sich schließlich asymptotisch einem Grenzwert, [AS]max. Dann ist die Oberfläche des Adsorptionsmittels mit dem Substrat gesättigt.
Erhöht man die Konzentration an Adsorbens [A], so kann auch mehr Substrat [S] adsorbiert werden. Die Kurven verlaufen höher. Erhöht man die Temperatur, nimmt die Adsorption ab; die Kurven verlaufen flacher.
Interessant an dieser Isotherme ist, dass man aus ihr ablesen kann, wie viel Stoff bei einer bestimmten äußeren Substratkonzentration in Gasphase bzw. Flüssigphase vom Adsorptionsmittel adsorbiert werden kann. So kann man aber auch die Qualität von Adsorbentien und von Lösemitteln kontrollieren.
Der Algorithmus der Langmuirschen Isotherme ist eine Hyperbel:
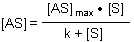
k ist eine temperaturabhängige Konstante.
Langmuir und Michaelis-Menten
Dem aufmerksamen Betrachter wird nicht entgangen sein, dass die Langmuirschen
Isothermen den Kurven der Michaelis-Menten-Gleichung
für Enzyme ähneln. Auch die Algorithmen sind identisch. Das ist nicht verwunderlich,
schließlich handelt es sich bei der Enzymreaktion primär auch um analoge Adsorptionsvorgänge,
wenn wir an die Kleinheit der normalen Substrate und der Größe der Enzyme denken. Statt der
Menge an adsorbiertem Substrat trägt man bei Michaelis-Menten die Umsetzungsrate des adsorbierten Substrats auf.
Beides entspricht einander: Denn nur zuvor adsorbiertes Substrat kann vom Enzym auch wirklich umgesetzt
werden.
Weitere Texte zum Thema „Chromatographie“