Citrat und Blaupausen (Cyanotypie)
Experimente:
Versuch: Das Prinzip von Blaupausen
Lange bevor es die modernen Fotokopierer gab, war die Herstellung von Vervielfältigungen
ein Problem. Bekannt sind die Blaupausen. Ein Rezept hierfür beruht unter
anderem auf der Verwendung eines Citrats, ein anderes auf der Verwendung eines
Oxalats.
Hier zunächst der Vorgang (->
Versuch)
Man löst Ammonium-eisen(III)-citrat und rotes Blutlaugensalz in Wasser. Diese Lösung
trägt man auf Papier auf und setzt das Ganze UV-Strahlen oder einer starken
Lichtquelle (Halogenlampe) aus. Das Papier färbt sich blau.
Wenn man zuvor eine Schablone auflegt, kann man entsprechende Abbildungen
erhalten und auf diese Weise vervielfältigen.
Der chemische Hintergrund
Es handelt sich um eine Redox-Reaktion, die durch Bestrahlung initiiert wird.
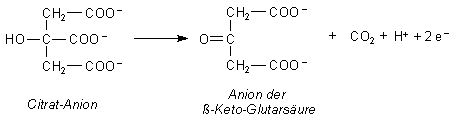
Das Eisen(III)-Ion oxidiert das Citrat-Anion. Formal gilt:

Es bildet sich aus dem Citrat durch Oxidation unter Abspaltung von CO2 das Anion der b-Keto-Glutarsäure, das über das b-Keto-Buttersäure-Anion weiter bis zum Aceton decarboxyliert wird. (In den Webseiten zur Chemie der Zitrone wird der oxidative Abbau von Citronensäure genau beschrieben.)
Eisen(III) wird zu Eisen(II) reduziert.
Fe3+ + e- ———> Fe2+
Die blaue Farbe rührt her von der anschließenden Reaktion des Eisen(II)-Ions mit dem roten Blutlaugensalz zum Berliner Blau.
Fe2+ + K3[Fe(CN)6] ———> K[FeIIFeIII(CN)6]+ 2 K+
Statt Eisen(III)-citrat hat man auch Eisen(III)-oxalat bzw. das Komplexsalz Ammonium-oxalato-ferrat(III) eingesetzt. Der Reaktionsmechanismus ist prinzipiell der gleiche wie beim Citrat. Das Oxalat-Anion wird zu CO2 oxidiert.
-OOC-COO- ———> 2 CO2 + 2 e-
Weitere Texte zum Thema „Zitrone“