Versuch: Bestimmung von Ascorbinsäure mit Tillmanns Reagenz
Schülerversuch; 30 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Hinweis
Dieser Versuch ist für Unterrichtszwecke wenig geeignet, weil die Erkennung des Äquivalenzpunktes
große Erfahrung erfordert. Aus diesem Grunde raten wir unbedingt davon ab, diesen Nachweis zur
quantitativen Bestimmung von Ascorbinsäure einzusetzen. Dies wird immer wieder im Rahmen von
Facharbeiten versucht.
Geräte
Becherglas, Erlenmeyerkolben (Weithalsform; 300 ml), Pipetten (25 ml), Bürette (50 ml).
Chemikalien
Ascorbinsäure, Dichlorphenolindophenol-Natrium (DCPIP), Natriumhydrogencarbonat, Zitrone,
pH-Indikatorpapier.
Durchführung
A Herstellung der Lösungen
Stelle 50 ml einer Lösung von Ascorbinsäure (c = 0,1 mol/l) und 100 ml Lösung von DCPIP (c
= 0,1 mol/l) her.
Fülle DCPIP-Lösung in die Bürette.
B Eichen der DCPIP-Lösung
Pipettiere 25 ml der Ascorbinsäurelösung in den Erlenmeyerkolben und stelle die Lösung mit
Natriumhydrogencarbonat in etwa neutral ein.
Anschließend titrierst du die Ascorbinsäurelösung mit DCPIP. Am Endpunkt entfärbt sich die
zugegebene Lösung nicht mehr.
C Auswertung der Eichmessung
Da 1 mol DCPIP mit 1 mol Ascorbinsäure reagiert, ist zur Auswertung der einfache Dreisatz
angesagt:
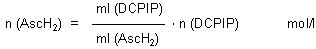
Da die Lösung an DCPIP im Allgemeinen um 1/10 zu verdünnt ist, weil DCPIP wasserhaltig
ist, erhältst du einen zu hohen Wert von nAscH2. Setze ihn deshalb zu der realen Molzahl der
vorgelegten Ascorbinsäure ins Verhältnis. Du erhältst einen Faktor f, durch den du den bei
Titrationen unbekannter Ascorbinsäure-Lösungen erhaltenen Wert von nAscH2 teilen musst.
Beispiel:
Statt der erwarteten 25 ml DCPIP-Lösung hast du 27,5 ml verbraucht.
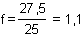
Für die Masse der Ascorbinsäure gilt dann:
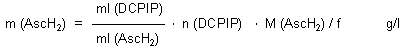
D Wiederhole die Messung
... mit Zitronensaft, ascorbinsäurehaltigen Medikamenten (Aspirin Plus), Obstsäften usw.