Schmelzflusselektrolyse zur Aluminiumgewinnung
In der Natur findet man Bauxit, das zur Herstellung von reinem Aluminium vorab aufgearbeitet werden muss. Bauxit wird zuerst in heißer, konzentrierter Natronlauge erhitzt. Dabei löst sich das Aluminiumhydroxid.
Al(OH)3 + NaOH à Na[Al(OH)4]
Man dekantiert ab, gibt einige Impfkristalle Aluminiumhydroxid zu und rührt dann während des
Abkühlens wieder das gelöste Aluminiumhydroxid aus.
Das so gereinigte Aluminiumhydroxid wird jetzt zu Aluminiumoxid geglüht.
2 Al(OH)3 à Al2O3 + 3 H2O
Reines Aluminium gewinnt man durch Elektrolyse von geschmolzenem Aluminiumoxid, dem zur
Senkung des Schmelzpunktes künstlich hergestelltes Kryolith (Na3AlF6)
zugesetzt wird. Die Fluorid-Ionen haben dabei eine katalytische Funktion.
Die Schmelze enthält letztlich etwa 7 - 12 % Aluminiumoxid.

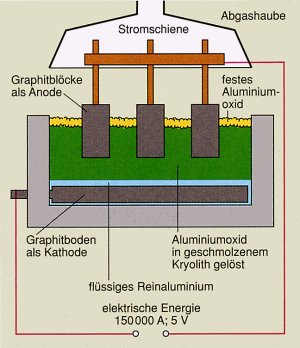
Schema einer Elektrolyseanlage zur Gewinnung von Aluminium
(Quelle: Cornelsen)
Bei der Elektrolyse wird Aluminiumoxid in Aluminium und Sauerstoff zerlegt. Die
Schmelzflusselektrolyse wird in Wannen aus Kohle, die gleichzeitig die Kathode bilden,
durchgeführt. Als Anoden dienen große Kohleblöcke, die von oben in die Schmelze tauchen.
Oxidation: 6 O2- à 3 O2 + 6 e-
Reduktion: 2 Al3+ + 6 e- à 2 Al
Redoxreaktion: 2 Al3+ + 6 O2- à 2 Al
+ 3 O2
Das entstandene flüssige Aluminium setzt sich am Wannenboden ab, und ist so durch die darüber schwimmende Schmelze vor der Oxidation durch den Luftsauerstoff geschützt.
Lies hierzu den vertiefenden Text "Gewinnung und Verwendung von Aluminium".
Weitere Texte zum Thema „Elektrochemie“