Lithium-Batterien
Elektrochemische Elemente auf der Basis von Lithium als Anodenmaterial spielen zunehmend eine wichtige Rolle. Sie gelten als besonders belastbar und zeigen auch eine geringe Neigung zur Selbstentladung. Deshalb sind sie lange lagerfähig. Sie verfügen auch über einen weiten Temperaturbereich, in dem sie stabil sind. Einige Zellen lassen sich wieder aufladen, sind also Akkumulatoren. Da sie eine sehr hohe spezifische Energiedichte haben (s. u.), kommen sie dem Trend zur Miniaturisierung von Kleinstgeräten besonders entgegen.
Die Grundlagen: Chemie des Lithiums
Der spannungsliefernde, anodische Grundprozess ist
Bei diesem einfachen Prozess ist kaum zu vermuten, dass es einiger Überlegungen bedarf, um ein Element auf dieser Basis zu bauen. Denn Lithium hat gewisse Nachteile, z. B., dass es sehr reaktiv ist. So reagiert es bereits mit Luftstickstoff zu schwarzen Nitriden, dies allerdings nur in Gegenwart von Wasser. Ansonsten bildet das Metall eine passivierende Schutzhaut von Oxiden, Hydroxiden und Carbonaten. (Die chemischen Eigenschaften von Lithium entsprechen in etwa denen von Magnesium; vergleiche Schrägbeziehung im PSE!) Trotz dieser Schutzschicht bleibt das Metall glücklicherweise elektrochemisch weiterhin aktiv.
Warum also überhaupt Anoden aus Lithium?
Lithium ist nicht selten. Außerdem ist es mit einer Dichte von 0,54 g/cm3
das leichteste aller Metalle, das auch zu dünnen Folien verarbeitet werden kann. Es hat
mit E0 = - 3,05 Volt das niedrigste Standardpotential der Metalle, sein Valenzwechsel
erfolgt leicht. Es hat einen für technische Zwecke vernünftigen Schmelzpunkt (180 °C).
Die spezifischen Energiewerte (bezogen auf Masse oder Volumen) sind ebenfalls recht günstig:
3,68 Ah/g bzw. 2,08 Ah/cm3.
Elektrolyte
1 Lösemittel
Wegen der Empfindlichkeit gegenüber Wasser muss man in der Lithiumtechnologie mit
wasserfreien, aprotischen organischen Lösemitteln oder Mischungen von Lösemitteln arbeiten.
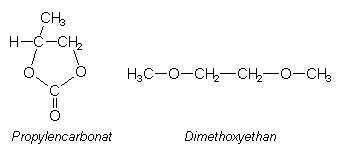
Beispiele sind 1:1-Mischungen von Propylencarbonat und Dimethoxyethan.

2 Leitsalze
Für die Funktion einer Batterie oder eines Akkumulators ist das Vorhandensein eines in
diesem Lösemittel löslichen Leitsalzes Voraussetzung. Ein solches ist bei aprotischen
Lösemitteln beispielsweise Lithium-Perchlorat LiClO4. Seine Löslichkeit
liegt im Bereich von 1 mol/l. Weitere Leitsalze sind Lithiumtetrafluoroborat LiBF4,
Lithiumhexachloroplatinat LiPtCl6 und so weiter. Sie bilden zusammen mit dem
Lösemittel den Elektrolyten.
3 Membranelektrolyte
Heute nutzt man (wie auch in der Brennstoffzellen-Technologie)
bereits Batterien auf Membran-Elektrolytbasis. Ein Beispiel ist Polyacylnitril.
Kathodenmaterial
Die ganze Variationsbreite der Lithiumbatterien beruht auf der Wahl des Kathodenmaterials.
Vor allem muss es eine ausreichend große Potentialdifferenz zum Lithium haben. Das
können auch die Lösemittel selbst sein. So hat die Schwefelverbindung Thionylchlorid
SOCl2 gegenüber Li eine Zellspannung von 3,65 Volt. Aber auch SO2 kann
genutzt werden.
Wichtig für wiederaufladebare Systeme sind Kathoden, die Li-Ionen reversibel einlagern
können. Dazu gehören Bismutoxid, Braunstein, Kupfer(II)-oxid, Kupfer(II)-sulfid,
Molybdänsulfid, Pyrit FeS2 und Vanadiumpentoxid.
Weitere Oxidationsmittel sind Iod und Kohlenstoffmonofluorid CF.
Praktische Beispiele für Lithiumzellen
1 Lithium/Braunstein-Zelle
Ruhespannung: 3,5 V; Lastspannung 2,9 V
Diese Batterie enthält als Anode Li-Metall, als Kathode Braunstein.
Elektrolytlösemittel sind 1:1-Mischungen von Propylencarbonat und Dimethoxyethan. Leitsalz
ist z. B. Lithiumperchlorat.
Der gesamte Redox-Prozess ist
Für ein über den äußeren Leiter geführtes Elektron wandert ein
Lithium-Ion in die Braunsteinmatrix und wird dort reversibel eingelagert. Das Braunsteingitter
bleibt somit weitgehend erhalten.
Beim Ladevorgang wird der Vorgang rückgängig gemacht.
2 Lithium/Graphitfluorid-Zelle
Ruhespannung: 3,0 V; Lastspannung 2,6 V
Die stromliefernde Reaktion ist
Graphitfluorid wird durch Einwirkung von Fluor auf Kohlenstoff (z. B. in der Form von Koks) bei hohen Temperaturen hergestellt. Der Elektrolyt besteht aus dem Lösemittelgemisch Propylencarbonat und Dimethoxyethan; Leitsalz ist Lithiumtetrafluoroborat LiBF4.
3 Lithium/Schwefeldioxid-Zellen
Ruhespannung: 3,0 V; Lastspannung 2,7 V
Die energieliefernde Entladungsreaktion ist
Als Elektrolytlösemittel dient Acetonitril, Leitsalz ist Lithiumbromid LiBr. Acetonitril ist zugleich ein hervorragendes Lösemittel für SO2.
4 Lithium/Thionylchlorid-Zellen
Ruhespannung: 3,7 V; Lastspannung 3,4 V
Thionylchlorid SOCl2 ist zugleich Lösemittel und Oxidationsmittel. Leitsalz
ist Lithiumtetrachloroaluminat LiAlCl4.
Die energieliefernde Reaktion ist
Lithium-Ionen-Batterien
Darunter versteht man Akkumulatoren, die für die Handy-Technologie, aber auch für die Stromversorgung
von Notbooks/Laptops sehr wichtig sind. Sie unterscheiden sich völlig von den klassischen Lithiumbatterien.
Deshalb widmen wir ihnen eine eigene Webseite.
Literatur
G. Eichinger und G. Demrau: Lithiumbatterien I und II, Chemie in unserer Zeit,
24 (1990), 32-36 und 90-96.
Internet: http://www.sonnenschein-lithium.de
Weitere Texte zum Thema „Elektrochemie“