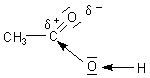
Warum ist die Essigsäure überhaupt sauer?
Experimente:
Versuch: Essig enthält eine Säure
Versuch: Wie viele Protonen setzt ein Essigsäuremolekül frei?
Säuren sind Protonen-Spender (-> Versuch). Theoretisch könnte Essigsäure
vier Protonen freisetzen. Sie gibt aber nur ein Proton ab (-> Versuch). Das kann
logischerweise nur das der Carboxylgruppe -COOH sein. Die Säureeigenschaft der Carboxylgruppe muss deshalb
ihren Grund in der Hydroxylgruppe haben. Das ist erstaunlich, denn Alkohole sind (wenn überhaupt) nur ganz
schwache Säuren, die eigentlich nur mit Alkalimetallen reagieren. Der Säure-Status von Alkoholen ist sowieso
umstritten: Sie geben keine Protonen an Basen wie Wasser ab. Alkohole sind im Sinne von Brönsted sogar eher
Basen, denn ihre OH-Gruppen können wie das Wassermolekül protoniert werden.
Für die Acidität der Hydroxylgruppe der Essigsäure gibt es jedoch zwei Gründe.
1. Grund
Die benachbarte Carboxylgruppe C=O wirkt Elektronen ziehend. Sie hat also einen -I-Effekt
(negativer induktiver Effekt). Damit wird die Bindung zwischen dem O und dem H gelockert.
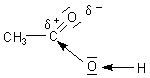
Dieser Effekt wird verstärkt, wenn H-Atome der Methylgruppe der Essigsäure durch Halogen-Atome substituiert werden. Die sind noch stärker Elektronen ziehend. Die Halogenessigsäuren sind deshalb auch entsprechend stärker sauer als die Essigsäure. Während der pKa-Wert von Essigsäure bei 4,75 liegt, beträgt der der Monochloressigsäure 2,86.
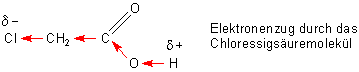
Dagegen wirkt sich die Verlängerung der C-Kette gegenteilig aus, denn Alkylgruppen haben einen +I-Effekt (positiver induktiver Effekt), das heißt, sie stoßen Elektronen ab und schieben sie in die Bindung zwischen O und H. Somit ist die Propionsäure weniger sauer als die Essigsäure. Ihr pKa-Wert beträgt 4,88.
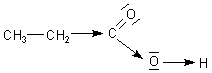
Genau genommen verfügt die Essigsäure ja auch schon über eine Alkylgruppe, die ihre Acidität verringert. Vergleichen wir die Essigsäure einmal mit der Ameisensäure, die statt der Methylgruppe nur ein H-Atom trägt. Die Ameisensäure ist sozusagen eine "Carboxylgruppe pur".
H-COOH
Ihr pKa-Wert beträgt nur 3,77. Ameisensäure reagiert deshalb innerhalb der homologen Reihe der Carbonsäuren am stärksten sauer.
2. Grund
Außerdem ist das entstehende Carboxylat-Anion durch Mesomerie stabilisiert. Die negative Ladung ist
delokalisiert. Das heißt, dass beide Sauerstoffatome völlig äquivalent sind. Das bewirkt eine Reduzierung
der potentiellen Energie des Systems.
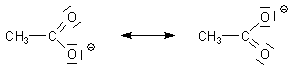
Grenzstrukturen des Acetat-Anions
Weitere Texte zum Thema „Essig“