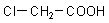
Einige wichtige Verbindungen und Derivate der Essigsäure
Experimente:
Versuch: Herstellung einer Folie aus Celluloseacetat
Versuch: Die Synthese von Aspirin
Versuch: Holzaufschluss mit dem Acetosolv-Verfahren
Versuch: Säurekatalyse bei der Estersynthese
Versuch: Darstellung von Estern mit Ionenaustauschern
Versuch: Lösen und Wiederaufschäumen von Polystyrol
Versuch: Untersuchung der Lösemittel in Lacken und Klebstoffen
Versuch: Herstellung eines lösemittelhaltigen Lacks
Versuch: Nucleophile Substitution an Halogenessigsäuren
Essigsäure ist nicht nur Genuss-Säure wichtig, die man Lebensmitteln zum Konservieren oder als
Geschmacksverstärker zusetzt. Essigsäure ist auch als polares Lösemittel mit zusätzlichen
unpolaren Eigenschaften wichtig. Da gibt es zum Beispiel Verfahren zum Holzaufschluss, bei denen die
Löslichkeit von Lignin in organischen Lösemitteln wie der Essigsäure ausgenutzt wird. Diese
Organosolv-Verfahren können wir in einem Experiment selbst nachvollziehen (->
Versuch).
Daneben gibt es aber eine Reihe von Verbindungen, die als Derivate der Essigsäure von großer Bedeutung sind. Hier wollen wir einige Beispiele ansprechen. Genaueres dazu können wir in Lehrbüchern zur Organischen Chemie wie zum Beispiel von Hans Beyer nachlesen (-> Literatur).
Halogenessigsäuren
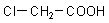
Chloressigsäure

Bild 1: Kalottenmodell der Chloressigsäure
(Foto: Blume)
Zur Herstellung reicht die direkte Einwirkung von Halogenen nicht aus. Denn die Essigsäure ist recht
reaktionsträge. Man kann die Halogenessigsäuren jedoch durch Lichtenergie und Katalysatoren wie Iod
oder Schwefel, die als Halogenüberträger wirken, gewinnen. Iodessigsäure stellt man her, indem man
Chloressigsäure mit Kalium-Iodid umsetzt (Substitution). Daneben gibt es noch viele andere,
stoffspezifische Herstellungsmethoden.
Halogenessigsäuren werden zwar auch zu den schwachen Säuren gezählt, weil sie in Lösung nicht vollständig dissoziiert sind. Das soll aber über ihre Aggressivität nicht hinwegtäuschen: Sie wirken wesentlich stärker sauer als die Essigsäure. Das zeigt der Vergleich der pKa-Werte.
| pKa | |
| Essigsäure
Fluoressigsäure Chloressigsäure Bromessigsäure Iodessigsäure |
4,75
2,57 2,86 2,89 3,16 |
Der Grund für die höhere Acidität ist, dass die stark elektronegativen Halogenatome Elektronen zu sich heranziehen (- I-Effekt). Dieser Elektronenzug wirkt sich bis zur O-H-Bindung aus, die dadurch gelockert wird.
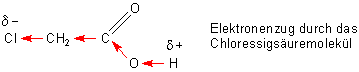
Entsprechend spielt auch die Zahl der Halogenatome in einem Essigsäuremolekül hinsichtlich der Säurestärke eine Rolle. Dadurch wird der - I-Effekt wesentlich verstärkt.
| pKa | |
| Essigsäure
Chloressigsäure Dichloressigsäure Trichloressigsäure |
4,75
2,86 1,29 0,65 |
Andererseits wird auch die Bindung zwischen Halogen und Säurerest durch den Elektronenzug der Carboxylgruppe -COOH gelockert. Das macht sich in der erhöhten Reaktivität der Halogenatome zum Beispiel beim nucleophilen Austausch durch die OH-Gruppe bemerkbar (-> Versuch).
Halogenessigsäuren sind stark ätzend. Aus diesem Grunde benutzt man sie zum Beispiel als Mittel gegen Haut-Warzen.
Chloressigsäure ist eine leicht sublimierende Substanz. Achten Sie einmal darauf, wenn Sie ein Gefäß mit dieser Substanz öffnen. Am Stopfen hängen hübsche lange Kristalle. Sie gehören zum monoklinen Kristallsystem. Das ist das gleiche System wie beim Schwefel. Auch die Kristalle von Saccharose ("Kluntjes") oder auch vom Gips gehören dazu.
| Klick mich an! |
 |
| Bild 2: Kristalle von Chloressigsäure
(Foto: Daggi) |
Essigsäurechlorid
Die bekannteste unter den vielen Methoden zur Darstellung ist die Reaktion von Essigsäure
mit Phosphor- oder Schwefelhalogenverbindungen wie Phosphortrichlorid PCl3
oder Thionylchlorid SOCl2.
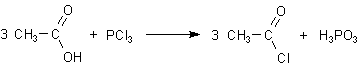

Bild 3: Kalottenmodell des Essigsäurechlorids
(Foto: Daggi)
Die stechend riechende Flüssigkeit benötigt man als Acetylierungsmittel. Mit Ammoniak
oder Aminen bilden sich zum Beispiel Essigsäureamide.
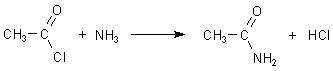
Als Nebenprodukt dieser Kondensationsreaktion entsteht Chlorwasserstoff, was manchmal stört - vor allem bei Veresterungsreaktionen, die ebenfalls mit Essigsäurechlorid erfolgen können.
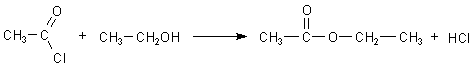
Die Ester werden bekanntlich durch Säuren (genau durch die katalytisch wirkenden Protonen) gespalten. Das unterbindet man, indem man organische Basen zusetzt.
Essigsäureanhydrid
Essigsäureanhydrid wird hergestellt, indem man zum Beispiel Essigsäurechlorid mit Natriumacetat
reagieren lässt.
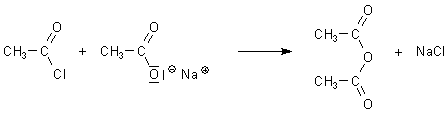

Bild 4: Kalottenmodell des Essigsäureanhydrids
(Foto: Daggi)
Essigsäureanhydrid reagiert ähnlich wie die Säurehalogenide, allerdings nicht so heftig. Die
Acetatgruppe ist eine gute Abgangsgruppe, die man zum Acetylieren von anderen Verbindungen nutzen kann.
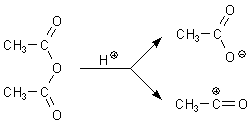
So nimmt man zur Synthese von Aspirin (-> Versuch) Essigsäureanhydrid und nicht einfach nur Essigsäure. Essigsäureanhydrid befindet sich energetisch bereits auf so hohem Potential, dass zur Veresterung nur noch eine geringe Aktivierung nötig ist. Dazu reicht Zimmertemperatur aus. Der Einsatz eines Katalysators wie konzentrierte Schwefelsäure entfällt zwar nicht ganz, man benötigt aber nur ganz geringe Mengen davon. Denn hierbei geht es vor allem um Protonenkatalyse. Die fördert die Spaltung des Anhydrids. Es fällt bei der Reaktion aber kein Wasser an, das von Schwefelsäure gebunden werden müsste. Deshalb liegt das Gleichgewicht immer auf der Seite der Esterbildung.
Weiter nutzt man Essigsäureanhydrid zur Herstellung von Celluloseestern (-> Versuch).
Für Schulen ist es schwer und mit hohem bürokratischen Aufwand verbunden, Essigsäureanhydrid zu beschaffen - denn damit kann man Unsinn machen. So können Schüler damit Morphin zu Heroin kochen. Letzteres ist der Essigsäure-di-ester des Morphins. Dies ist ein Beispiel für "Dual Use".
Essigsäureester
Ganz besonders wichtig unter der Vielzahl der möglichen Ester ist der Essigsäureethylester, kurz
Essigester oder auch Ethylacetat genannt.
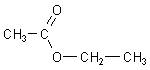

Bild 5: Kalottenmodell des Essigsäureethylesters
(Foto: Daggi)
Die klassische Herstellung mit Schwefelsäure als Katalysator beschreiben wir in Versuch.
Eine umweltschonendere Alternative bietet dieser Versuch.
Essigester benötigt man vor allem als Lösemittel. Er löst besonders Kunststoffe wie Polystyrol (-> Versuch) und kann deshalb als Lacklösemittel dienen (-> Versuch). Wir können auf diese Weise selbst einen Lack herstellen (-> Versuch). Essigester ist Hauptbestandteil der Nitroverdünnung. (Die Bezeichnung kommt daher, weil man früher Nitrolacke damit verdünnte.) Auch Klebstoffe enthalten oftmals dieses Lösemittel. So wird der Geruch des Essigesters mit dem von UHU® gleichgesetzt.
Aber auch das ansonsten in nichts lösliche Chitin quillt zumindest in Essigester und wird weich. Das wissen Entomologen (Insektenforscher) zu schätzen, die sich auf diese Weise die Beine und Fühler ihrer Tiere für die Insektensammlung wie gewünscht hinbiegen können.
Ein Nachteil des Essigesters sind zunächst der niedrige Siedepunkt (77,1 °C) und die leichte Entflammbarkeit. Hinzu kommt aber noch, dass Essigester auch betäubend wirkt. Deshalb also Vorsicht beim Arbeiten damit!
Acetonitril
Acetonitril ist das Nitril der Essigsäure. Dieses wichtige Lösemittel erhält man, wenn man Methyl-iodid mit
Kaliumcyanid umsetzt.

Bild 6: Kalottenmodell des Essigsäurenitrils
(Foto: Daggi)
Acetonitril ist bei weitem nicht so giftig wie Blausäure. Entsprechend häufig wird es im Labor benutzt. Es ist
ein wichtiges Lösemittel - zum Beispiel bei chromatographischen Verfahren wie der HPLC.
Aminoessigsäure
Dies ist die chemische Bezeichnung für Glycin, die einfachste Aminosäure.
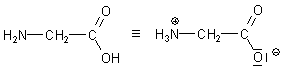
Dazu gibt es so viel zu sagen, dass wir der Aminoessigsäure eine eigene Webseite gewidmet haben.
Weitere Texte zum Thema „Essig“