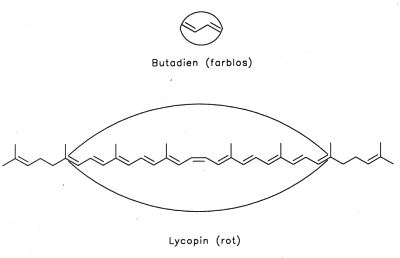
Bild 1: Akustisches Modell für den roten Farbstoff der Tomate und seine formale Vorstufe
Warum sind Farbstoffe farbig?
Experimente:
Versuch: Aromatenprobe
Versuch: Synthese von Phenolphthalein
Versuch: Synthese von Fluorescein
Versuch: Synthese eines Azofarbstoffes
Versuch: Synthese von ß-Naphtholorange
Versuch: Synthese von Indigo
Versuch: Färben mit Berliner Blau
Versuch: Färben mit Anilinschwarz
Versuch: Beizenfärbung
Versuch: Küpenfärbung mit Indigo
Farbige Stoffe sind chemische Substanzen, die aus dem sichtbaren Licht
spektrale Anteile absorbieren (subtrahieren). Der nicht absorbierte Teil addiert sich zur
komplementären Eigenfarbe des farbigen Stoffs. Wird das gesamte Licht absorbiert, erscheint
der Stoff schwarz. Wird kein Licht absorbiert, ist der Stoff weiß.
Farbmittel sind Stoffe, die alle Eigenschaften haben, um daraus Farben bereiten
zu können, oder die zum Färben geeignet sind. Man unterscheidet Farbstoffe und (Farb-)Pigmente.
Farbstoffe sind lösliche Farbmittel.
(Farb-)Pigmente sind schwerlösliche Farbmittel.
Farben sind Zubereitungen, die Farbstoffe enthalten.
Färben ist die Fixierung des Farbstoffs auf oder in der zu bearbeitenden
Matrix.
(Auf die stringente Unterscheidung zwischen farbigen Stoffen und Farbstoffen verzichten wir in den folgenden Texten, da es uns hier in erster Linie um chemische Stoffe, die farbig sind, geht.)
Farbstoffe enthalten leicht anregbare Elektronen. Nur so sind sie in der Lage, aus dem sichtbaren Licht Spektralbereiche zu absorbieren. Die "Lockerung" von Elektronen lässt sich auf verschiedene Art und Weise erreichen:
In welchen Bereichen des elektromagnetischen Spektrums absorbieren Moleküle?
Grundsätzlich schwingen die Elektronen im elektromagnetischen Wechselfeld der
einfallenden Strahlung. Für die energetische Wechselwirkung ist die Größe des schwingenden
Systems bedeutsam:
Sind Zahl und Verteilungsraum der Elektronen klein, so schwingt das System sehr rasch, die
Anregungsenergie ist hoch, die absorbierte Strahlung liegt im UV-Bereich.
Sind Zahl und Verteilungsraum der Elektronen groß, so schwingt das System langsam,
die Anregungsenergie ist niedrig, das Molekül absorbiert langwellige Schwingungen aus dem
sichtbaren Spektralbereich.
Zur Erläuterung kann das akustische Modell herangezogen werden.
Kurzwellige Schwingungen bedeuten hohe Energie und hohe Töne, langwellige Schwingungen niedrige Energie
mit dunklen Tönen.

Bild 1: Akustisches Modell für den roten Farbstoff der Tomate und seine formale Vorstufe
Farbvertiefend wirken besonders aromatische Systeme. Auch endständige
Gruppen mit freien Elektronenpaaren an Atomen von Stickstoff, Sauerstoff oder den Halogenen
wirken sich positiv aus. Gleiches gilt aber oftmals auch
für positive oder negative Ladungen im Molekül. Generelle Regeln lassen sich
allerdings nicht ohne weiteres geben.
Weitere Texte zum Thema „Farbstoffe und Färben“