Halochromie
Experimente:
Versuch: Die gepufferte Schönheit des Rotkohlsafts oder
Wie man Rotkohlsaft kornblumenblau färbt
Versuch: Synthese von Phenolphthalein
Versuch: Substantivfärbung mit künstlichen Farbstoffen
Versuch: Substantivfärben mit Biofarbstoffen
Manche Stoffe zeigen ihre Farbigkeit erst bei bestimmten pH-Werten oder wechseln
milieubedingt ihre Farbe. Diese Eigenschaft nennt man Halochromie ("Salz-Farbigkeit"). Man
nutzt solche Farbstoffe als Indikatoren. Das klassische
Beispiel sind Pflanzenfarbstoffe wie die
Anthocyane, die z. B. im Rotkohlsaft enthalten sind.
Zu halochromen Verbindungen gehören weiter Phenolphthalein (-> Versuch
2) und Kongorot (-> Versuch 7). Ihre Farbigkeit
rührt meistens daher, dass sie bei verschiedenen pH-Werten unterschiedliche
Ladungszustände aufweisen.
Farbstoffe, die je nach pH-Wert andere Farben zeigen, sind zum Färben nur begrenzt
geeignet.
Einige Beispiele:
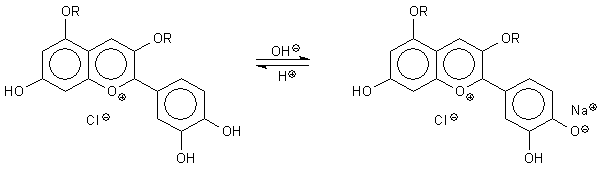
1 Anthocyane

Bild 7: Zwei halochrome Formen des Cyanidins
2 Phenolphthalein
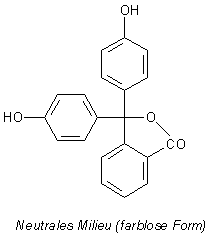
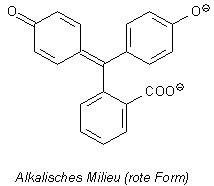
Bild 8: Halochrome Formen von Phenolphthalein
3 Kongorot
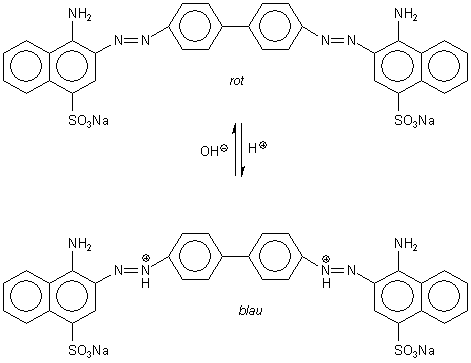
Bild 9: Halochrome Formen von Kongorot
Weitere Texte zum Thema „Farbstoffe und Färben“