Fluoreszenz
Experimente:
Versuch: Synthese und Verwendung von Fluorescein
Was geschieht eigentlich mit dem absorbierten Licht? Die meisten Farbstoffe wandeln die
elektromagnetische Energie des Lichts um in Schwingungsenergie, d.h. ihre Moleküle fangen
an, charakteristisch zu schwingen. Letztlich bedeutet das die Entwertung der
Strahlungsenergie zu Wärme.
Einige Stoffe jedoch sind aufgrund der Struktur ihrer Moleküle an der Schwingung mehr oder
weniger gehindert. Sie müssen die absorbierte Strahlungsenergie wieder als Strahlungsenergie
abgeben. Diese Emission nennt man Fluoreszenz. Da auch ein sterisch gehindertes
Molekül immer ein wenig schwingt, ist die Fluoreszenzstrahlung etwas niedrigenergetischer,
also langwelliger als die anregende Strahlung.
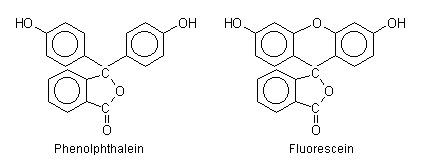
Ein beispielhafter Farbstoff, den man selbst herstellen kann, ist das
Fluorescein (-> Versuch 3),
dessen Moleküle ähnlich wie die des Phenolphthalein gebaut sind. Der
strukturelle Unterschied zwischen den beiden Verbindungen, der zur Fluoreszenz führt,
liegt in der Sauerstoffbrücke zwischen zwei Benzolringen. Dadurch wird seine Fähigkeit
zur Schwingung eingeschränkt.

Bild 1: Phenolphthalein und Fluorescein im Vergleich
Man kann den Farbstoff auch in Kunststoffe einbauen. Bekannt sind die Geräte für den Geometrieunterricht.
Aber auch Trinkbecher werden dadurch leicht erkennbar - vor allem im „Dunkellicht“ von Diskos. Das Dunkellicht
ist bekannt als UV-Strahlung, die den Farbstoff anregt.

Bild 2: Fluoresceinhaltiger Trinkbecher am Wegesrand
(Foto: Blume)
Weitere Texte zum Thema „Farbstoffe und Färben“