Redoxprozesse an getrennten Orten: Elektrochemie Redoxgleichungen leitet man her, indem man die Gesamtreaktion in einen Reduktions- und
einen Oxidationsteil zerlegt. Dass diese Zerlegung nicht nur formale Bedeutung hat, sondern
auch praktische, zeigt die Chemie der Elektrolyse und der galvanischen Elemente.
Hier verlaufen die Reduktion und Oxidation an getrennten Orten ab. Der Elektronenfluss
wird über einen äußeren Leiter geführt und kann im Fall der
Galvanischen Elemente zur Gewinnung von elektrischer Energie dienen.
Elektrolyse und galvanische Elemente sind somit zwei Seiten einer Medaille
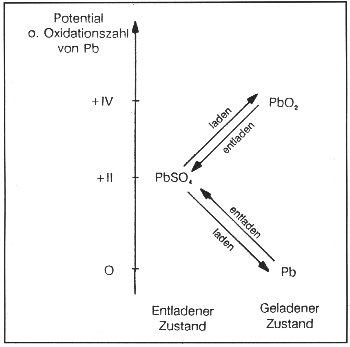
(-> Bild). Bei der Elektrolyse erzwingt man ein Potential, das beim Betrieb
als galvanische Zelle wieder abgebaut wird. Dies verdeutlicht die Abb. für
den Bleiakkumulator: Bild: Schematisches Redoxpotentialsystem des Bleiakkumulators.

Es gibt drei Gruppen von galvanischen Elementen: Batterien, Akkumulatoren und Brennstoffzellen.
1. Batterien
Batterien sind galvanische Elemente, die chemische Energie direkt in elektrische Energie
umwandeln. Das Potential bestimmter Redox-Reaktionen wird zur Erzeugung von Strom
genutzt.
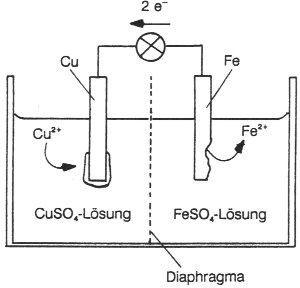
Schaltet man einen Kupfer- gegen einen Eisenstab, die beide jeweils in ihre Salzlösungen getaucht werden, so baut sich zwischen beiden Elektroden eine Spannung auf (-> Bild). Verbindet man sie, so fließt ein Strom. Dabei beobachtet man, dass sich Kupfer aus der Kupfersalzlösung auf der Kupferelektrode niederschlägt: Pluspol, während sich gleichzeitig die Eisenelektrode auflöst. Wir haben es hier mit einer einfachen Batterie zu tun.
Bild: Galvanisches Element (Cu/Fe)
2. Akkumulatoren
Wenn der spannungsliefernde Vorgang reversibel ist, spricht man von Akkumulatoren.
Ein modernes Beispiel ist die neue, im Gegensatz zum Bleiakkumulator sehr leichte
Natrium-Schwefel-Zelle
, bei der die nach rechts ablaufende Redoxreaktion bei
höherer Temperatur Strom liefert:
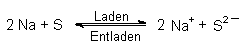
Die Rückreaktion kann man erzwingen, indem man eine äußere Spannung anlegt. Dies geschieht durch Elektrolyse.
3. Brennstoffzellen
Nutzt man Oxidationsprozesse aus, die normalerweise als Verbrennungen ablaufen,
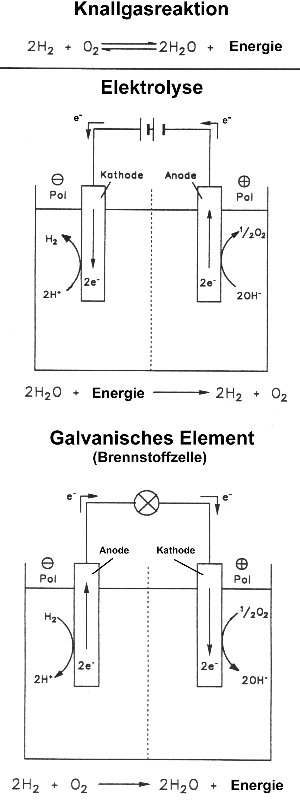
so erhält man die Brennstoffzelle wie z. B. die Knallgaszelle:
2 H2 + O2 ——> 2 H2O + Energie
In einem Elektrolyten befinden sich zwei Edelmetallelektroden, die durch ein Diaphragma getrennt sind. Man leitet über die eine Elektrode Wasserstoffgas, über die andere Sauerstoff. Es finden die bekannten Redoxreaktionen statt:
Anode (Oxidation): 2 H2 ——> 4 H+ + 4 e¯ (Minuspol)
Kathode (Reduktion): O2 + 2 H2O + 4 e¯ ——> 4 OH¯ (Pluspol)
Die Edelmetallelektroden spielen die Rolle eines Redox-Katalysators. Elektrolyt ist im allgemeinen Kalilauge. Damit werden auch die Protonen weggefangen, die den Fortgang des Prozesses hemmen.
Als Reduktionsmittel eignen sich auch Kohlenwasserstoffe, Methanol und Ethanol.
Problematisch ist bei Brennstoffzellen vor allem die Entwicklung guter Katalysatoren, die Redoxprozesse auch mit ungeladenen Molekülen von Reduktionsmitteln ermöglichen.
Auch bei den Brennstoffzellen liegen Elektrolyse und Betrieb eines galvanischen Elements eng zusammen: z. B. gewinnt man das Reduktionsmittel Wasserstoff durch Elektrolyse von Wasser und lässt es in der Brennstoffzelle wieder zu Wasser reagieren.
Bild: Elektrolyse und galvanisches Element als umkehrbares System
Text und Bilder entnommen aus: [3, Kap. 13.8]