 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
701
F: Ich bin neulich gefragt worden, was denn der Unterschied zwischen
Kohlendioxid und Kohlenmonoxid sei. Na ja, als Umwelt- und Bauingenieur konnte ich das wohl noch grob beantworten
- auch wenn mein Chemieunterricht schon ein wenig her ist.
Aber so ein bisschen bin ich bei der Frage ins Grübeln gekommen, wieso denn
CO überhaupt existiert? Da gibt es keine sich ergänzenden 8 Elektronen! Die
beiden Moleküle (C+O) teilen sich die vorhandenen Elektronen auch
untereinander nicht! Eine elektrische Ladung ist auch nicht vorhanden...
Was für eine Art von Verbindung besitzt denn CO?
A: CO ist dreifach gebunden, ist isoelektronisch mit N2.
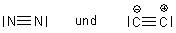
Dadurch hat das C-Atom (verglichen mit elementarem C-Atom) ein Elektron zuviel und erhält eine formale
negative Ladung, das O-Atom hat ein Elektron zuwenig und erhält eine formale positive Ladung.
Hierhin gehört auch das Cyanid-Ion.
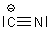
Auch hier hat das C-Atom ein Elektron zuviel, beim N-Atom stimmt alles. Damit ist das Cyanid ein negativ
geladenes Ion. Die negative Ladung wird durch ein positives Ion wie K+ eliminiert; wir erhalten
die Cyanide wie Zyankali KCN. Bei der Blausäure HCN wird statt des K+ ein H+ angedockt.
Übrigens gilt die Diskussion auch für Ethin
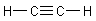
sowie für dessen Di-Anion C22-, das im Calciumcarbid CaC2 vorkommt.
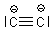
Dies alles ist ein schönes Beispiel für den Begriff "Allgemeine" Chemie. Man sieht, dass man mit wenigen Regeln den Aufbau vieler scheinbar völlig verschiedener Substanzen erklären kann.
702
F: Wir nehmen im Chemieunterricht gerade Eisenoxid durch. Unser Lehrer
fragte uns, was das bekannteste Eisenoxid ist. Können sie es mir erklären?
A: Das kommt darauf an, was man in welcher Gegend kennt.
FeO kennt der Mann in der Schmiede oder im Stahlwerk, aber auch den Eisenhammerschlag Fe2O3.
Letzterer tritt auch als Hämatit im österreichischen Eisenerztagebau auf.
Fe2O3 mit H2O (Limonit) kennt der Mann auf der Schwäbischen Alb als Bohnerz.
Ähnlich ist das Raseneisenerz aufgebaut, aus dem die Leute im Mittelalter den Stahl für ihre Ritterrüstungen
gewannen.
Und nicht nur in Schweden kennt man den Magnetit (Fe3O4), sondern auch an den Stränden
der Ostsee oder der kanarischen Inseln.
Letzteres ist momentan weltweit das am häufigsten abgebaute Erz. Vielleicht meint dein Lehrer das mit seiner
Frage...
703
F: Wir haben vor kurzem im Physikunterricht die Elektrolyse kennengelernt.
Unser Lehrer (der leider überhauptnichts von Chemie versteht) hat einen Elektrolysevorgang mit Wassser (und
H2SO4 als Kathalysator) vorgeführt.
Währe es möglich auf diese Weise H2SO4 zu konzentrieren?
A: Es ist richtig: Du konzentrierst die Schwefelsäure auf, weil du
ja ständig Wasser entfernst. Allerdings ist das eine sehr teure und umständliche Methode.
704
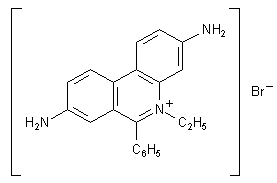
F: Ich bin bei meinen Nachforschungen für meinen BOGY-Bericht auf den
Stoff "Ethidiumbromid" gestoßen. Er wird bei der Gelelektrophorese der DNA beigesetzt um sie unter UV-Licht
sichtbar zu machen. Auf einigen Internetseiten wurde als Formel "Et-Br" angegeben. Nun konnte ich in keinen,
mir zugänglichen Periodensystem, das Elemet Et oder Ethidium finden. Können Sie mir nun bitte sagen, um was
für ein Element es sich dabei handelt, oder ob es eine Verbindung ist.
A: Ethidium ist kein Element, sondern es handelt sich um ein großes
organisches Molekül, das mit der DNA wechselwirkt. Modern heißt es übrigens Homindiumbromid.
705
F: Warum verwenden Galvaniseure für das Vergolden und Versilbern
giftige und umweltproblematische Cyanidlösungen ? Warum funktioniert es nicht mit jedem Elektrolyt wie zB
einer Kochsalzlösung und einer massiven Gold- oder Silberanode?
A: Es bilden sich die Cyanokomplexe, die die einzigen gut löslichen
Verbindungen dieser Metalle sind. (Beim Kupfer gilt das für die Oxidationsstufe I). Es bilden sich im
allgemeinen Cyanid-Komplexe der Metalle. Beispiel ist der Goldkomplex K[Au(CN)2], der schon bei
der Goldgewinnung entsteht. Die Halogenide AuCl, AgCl und CuCl zum Beispiel sind schwerlöslich.