|
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1161
F: Wie kommt das Salz ins Maggi?
A: Maggi gehört zu den Speisewürzen und ist tatsächlich sehr
kochsalzhaltig. Um das zu verstehen, muss man wissen, wie diese Würze hergestellt wird: Proteine werden
mit Salzsäure hydrolysiert. Dabei entstehen Peptide, Aminosäuren und andere, vor allem geschmacksbildende
Inhaltsstoffe. Anschließend wird die Mischung neutralisiert - mit Natronlauge. Dabei entsteht Kochsalz -
als Würzzusatz durchaus geschätzt. Patienten, die vielleicht wegen Bluthochdruck salzarme Diät bevorzugen,
sollten deshalb die Finger davon lassen.
1162
F: Als Chemie-Lehrer hier am Gymnasium profitierte ich schon auf
vielfältige Weise von Prof. Blumes Tipps und Anleitungen und damit auch von Ihrer Arbeit - herzlichen
Dank dafür.
Könnten Sie mir die Rezeptur für ein Messig-Reinigungsbad zukommen lassen?
A: Das Problem ist, dass es "das" Messing nicht gibt. Hinzu kommt,
dass es eine Legierung aus relativ unedlen Metallen ist, die nebeneinander vorliegen. So sind auch die
Überzüge unterschiedlich zusammengesetzt. Es gibt nur gemischte Verfahren: Chemische und mechanische.
Deshalb sind mir keine Messing-Reinigungsbäder bekannt, wohl aber Reinigungspasten.
Hier sind die Anforderungen an deren Zusammensetzungen: Zunächst muss man die Oberfläche entfetten,
z. B. durch Alkohol und/oder Tenside. Dann wird der Belag chemisch abgeätzt, z. B. durch schwache Säuren
wie die Essigsäure. Dann folgt im allgemeinen eine mechanische Reinigung durch Reiben z. B. mit Salz,
dessen Härte nicht zum Zerkratzen führt. Die Endpolierung erfolgt mit Filz.
Sie können von vornherein auch mit Ultraschall in einem Essigsäurebad arbeiten. Um das mühevolle
Endpolieren kommen Sie dabei aber auch nicht herum.
1163
F: Was passiert, wenn man in einen Bleiakku (Autobatterie) aus
Versehen das Komplexsalz Dikalium-tetrachloroplatinat(II) K2[Pt (Cl4)] nachfüllt?
Ich vermute, das eine Ligandensubstitution stattfindet mit dem schwerlöslichen PbSO4. Kann ein
Platinkomplex entstehen, der mit einem oder zwei Sulfat-Ionen substituiert ist? Spielt der trans-Effekt
eine Rolle?
Der Bleiakkumulator wird vermutlich nicht mehr aufgeladen werden können, aber was genau passiert?
A: Das Prinzip kenne ich noch aus meiner Studienzeit. Da haben
wir einem Assi, den wir nicht mochten, in seinen VW-Akku Silbernitratlösung geträufelt. Das ging auch...
Es handelt sich m. E. nur um einen schlichten Redox-Effekt: Blei reduziert Pt(II) zu Pt. Das schlägt
sich auf den Bleiplatten nieder und bildet Lokalelemente. Folge: Herabsetzung der Überspannung von
Wasserstoff als Voraussetzung für das Laden eines Akkus. An den Lokalelementen wird deshalb beim Laden
nur Wasserstoff gebildet, aber kein Blei aus Bleisulfat abgeschieden.
1164
F: Ich habe mit meinen Schülern die Entzündungstemperatur eines
Streichholzkopfes gemessen. Dazu haben wir den Streichholzkopf in einem Glas erhitzt. Wir erhielten
einen Wert von 222 Grad Celsius, der sehr stark vom Literaturwert in ihrem Chemiebuch auf S. 85
(60 Grad Celsius) abweicht. Handelt es sich bei der Angabe um einen Druckfehler, wurde nach einer
anderen Methode gemessen oder gibt es derartig unterschiedliche Streichhölzer?
A: Sie haben sicherlich eine schöne Messung gemacht, diese
ist aber im Ansatz nicht richtig gelaufen. Die Zündtemperatur liegt tatsächlich wesentlich niedriger.
Könnte man Streichhölzer sonst durch leichtes Reiben an der Reibfläche der Streichholzschachtel entzünden?
Erinnern wir uns: Die Zündung beruht auf dem Zusammenwirken in einem Zweikomponentensystem: Dem Kopf und der Reibfläche. Und nicht auf einer Reaktion im Zündholzköpfchen allein!
Im Zündkopf sind vor allem die Oxidationsmittel für die Zündung enthalten (also Kaliumchlorat, Kaliumnitrat und Aktivatoren wie Braunstein oder Kaliumchromat). Auf der Reibfläche ist der rote Phosphor. Deren stark exotherme Reaktion entwickelt die Aktivierungsenergie zur Einleitung der Zündung des Holzes. Wenn Sie nun, was Sie auch sagen, die Zündtemperatur ausschließlich vom Streichholzköpfchen untersucht haben, so haben Sie nachgewiesen, dass bei ca. 220 °C die Zersetzungstemperatur von Kaliumchlorat und -nitrat erreicht ist. Diese setzen Sauerstoff frei, der bei dieser hohen Temperatur zunächst mit im Köpfchen enthaltenen Schwefelspuren, anschließend mit den organischen Bindemitteln Dextrin oder Gummi reagiert und dann vielleicht das Holz anzündet.
Ihr "Fehler" ist also, dass Sie nicht berücksichtigt haben, dass beim Streichholzentzünden tatsächlich eine ganz andere Reaktion abläuft als die Zersetzung der Oxidationsmittel, nämlich (formal geschrieben):
(KNO3/KClO3) + P(rot) ———> (KNO2/KCl) + P-Oxid + Energie
Zur Einleitung dieser stark exothermen Reaktion, die anschließend das Holz in Brand setzt, reicht die Reibungswärme auf der glaspulverhaltigen Reibfläche aus. Und das sind sicherlich nicht mehr als 60 °C.
Wenn Sie den Versuch richtig machen wollen, hier die Vorschrift:
Achtung: Der rote Phosphor wird im Vorratsgefäß aus Sicherheitsgründen feucht gehalten. Deshalb diesen
vorher einige Tage in einem Exsikkator über konz. Schwefelsäure oder Kaliumhydroxid absolut trocknen!!
Streichholzkopfmasse und gut getrockneten roten Phosphor mischen und in einem geschlossenen Raum mit der
Möglichkeit zum Gasdruckausgleich langsam hochheizen. Temperatur mit einem Thermoelement messen.
In diesem Zusammenhang ist vielleicht interessant, dass man früher tatsächlich zunächst im Streichholzkopf Kaliumchlorat und zunächst giftigen weißen, dann roten Phosphor gemischt hat (sog. "Phosphorhölzchen"). Jeder Raketenbastler weiß, dass das ein höchst explosives Gemisch ist. Daher ist es nicht verwunderlich, dass diese Streichhölzer zur Selbstentzündung neigten und tatsächlich in heißen Räumen, also auch in Hosentaschen oder in von der Sonne beschienenen Autos hochgingen. Erst mit der Trennung von Oxidationsmitteln und Phosphor gelangte man zu den "Sicherheitshölzern", die uns heute in der Hosentasche oder im heißen Auto gefahrlos begleiten.
1165
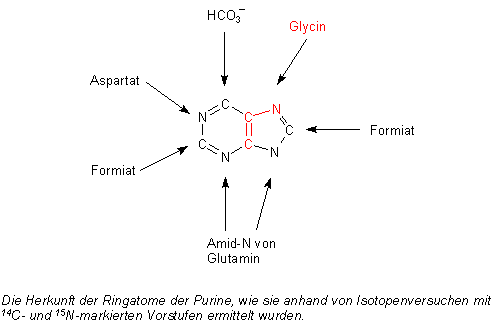
F: In einer Publikation habe ich gelesen, dass man Glycin in der Dunkelmaterie
von unserer Galaxis gefunden hat. Da stand auch, dass aus Glycin und anderen Aminosäuren Nukleinsäuren aufgebaut
werden. Ist das richtig? Ich dachte bislang, dass Aminosäuren die Grundbausteine der Peptide und Proteine sind.
A: Früher dachte man, dass am Anfang der biochemischen Evolution die
Proteine standen (griech. proton, erstes). Heute nimmt man an, dass es wohl die Nukleinsäuren waren - vor
allem seit man weiß, dass auch die RNA enzymatische Aktivitäten besitzen.
Die Basen der Nukleinsäuren werden unter Mitwirkung von Aminosäuren aufgebaut. Ganz besonders wichtig sind hierzu
die besonders einfachen Aminosäuren Glycin, Asparaginsäure und Glutamin. Hinzu kommen noch C1-Bausteine wie
das Formiat oder (formal) Formaldehyd, die man auch im Sternenstaub findet. Das spiegelt alles die "moderne" Synthese
der Basen wieder.