 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1656
F: Ich habe mehrere Fragen zu Energiesparlampen:
Warum leuchten diese zuerst rötlich, um dann später eine ganz 'normale gelbe' Farbe anzunehmen?
Und warum verschwindet diese Rotfärbung bei mehrmaliger Nutzung immer schneller?
Womit sind Energiesparlampen gefüllt? Warum sollte man sie wieder zurück geben?
Ansonsten bin ich ein regelmäßiger Nutzer Ihrer tollen Chemieseiten! Ich lese immer mit Begeisterung den Tipp des Monats und freue mich, weil die Sachen anschaulich erklärt werden, meist einen Bezug zum Alltag haben und auch für den Normalbürger verständlich sind. Denn Chemie war und ist für die meisten Erwachsenen und Schüler ein abschreckendes und langweiliges Fach.
A: Energiesparlampen sind mit Edelgasen und Quecksilberdampf gefüllt.
Wegen des giftigen Quecksilbers muss man sie zurückgeben und nicht in den Hausmüll entsorgen.
Die rötliche Lichtfärbung entsteht dadurch, dass zuerst die Edelgase zum Leuchten angeregt werden. Deren Licht ist rötlich. Neon z. B. strahlt ein rotes Licht aus. (Obwohl man immer meint, dass Neonröhren weißes Licht abstrahlen!) Mit zunehmender Temperatur macht sich auch das Quecksilber auf den Weg zur Dampfform. Dessen UV-Strahlung sorgt für Anregung der weißen Pigmente an der Glaswand. Daher die zeitliche Verzögerung. Warum diese Phase immer kürzer wird, weiß ich nicht. Dieses rote Vorleuchten erkennt man auch beim abendlichen Einschalten der Straßenbeleuchtung.
Zu den verschiedenen Lichtquellen haben wir einen Tipp des Monats.
1657
F: Ich habe von meinem Vater eine alte Salzlampe übernommen. Die stand lange herum,
unter anderem auch in meinem Schlafzimmer. Nun wollte ich sie in Betrieb nehmen und stelle fest, dass sie regelrecht zu
schmelzen scheint. Was ist das los? Ist die Schmelze gefährlich? Ich habe von der Brühe etwas an die Finger bekommen.
A: Es handelt sich wohl um einen dieser Lampenkörper, die man in farbiges,
durchscheinendes Salz geschnitten hat. In dem Hohlraum befindet sich eine elektrische Beleuchtungsvorrichtung.
Diese Salzbrocken sind echte Naturprodukte. Sie bestehen nicht aus reinem Stein- oder Kochsalz, sondern enthalten viele andere Salzarten. Einige wie Magnesiumsulfat oder –chlorid saugen den Wasserdampf aus der Umgebungsluft an; sie sind hygroskopisch. Das kann so weit gehen, dass der Salzblock regelrecht zerfließt. Besonders in Schlafzimmern ist es häufig feucht.
Diese Salzlösungen sind gesundheitlich nicht gefährlich, können aber die Unterlage aus Holz oder aus Naturstein schädigen. Deshalb muss mit viel Wasser schnell und gut sauber gemacht werden.
Den Salzkörper der Lampe sollte man rasch entsorgen, z. B. in den Hausmüll.
1658
F: Was versteht man unter der Dimerisierungskonstanten?
A: Dimerisierung ist die Reaktion zwischen zwei identischen Teilchen
(Monomere) unter Bildung eines Assoziats (Dimeres).
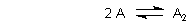
Im Allgemeinen ist das eine Gleichgewichtsreaktion. Die Lage des Gleichgewichts beschreibt man wie bekannt mit einer Konstanten. Die heißt hier Dimerisierungskonstante und ist so definiert.
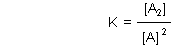
1659
F: Betreff: sehr wichtige Frage: warum eine salzwasserlösung schneller heiß wird
als normales leitungs wasser????????
Im Chemieunterricht in Klasse 7 haben wir herausgefunden , dass eine gesättigte Salzwasserlösung schneller warm wird als normales Leitungswasser aus dem Wasserhahn. Da es nicht mal unser Lehrer wusste wollte ich sie fragen warum es so ist.
Bitte um Baldige Antwort
A: Vorneweg erst einmal: Zugeführte Wärme bewirkt, dass sich die kleinsten Teilchen
des Wassers (Moleküle) schneller bewegen müssen. Das wird vom Thermometer als erhöhte Temperatur registriert.
In normalem Wasser hängen die Wassermoleküle stark aneinander. Das kennt ihr von der Oberflächenspannung. Um sie zu trennen, braucht man viel Wärme. Oder man muss länger erhitzen.
In gesättigter Salzlösung wird der Zusammenhalt der Wassermoleküle durch die vielen Teilchen des gelösten Salzes (Ionen) gestört. Die hängen allesamt nicht mehr so fest aneinander. Deshalb muss man nicht so lange erhitzen, um eine bestimmte Temperatur zu erreichen.
Man sagt, dass die Wärmekapazität von Wasser größer ist als die einer Salzlösung.
Wer mehr wissen will, klicke hier.
1660
F: Bei einen Kindergeburtstag haben meine Kinder die so genannte "Trickkerze" gesehen.
Nach dem "Auspusten" geht diese wieder an. Meine Kinder haben mich gefragt, wie diese Kerze funktioniert. Leider konnte ich meinen
Kindern keine Antwort geben. Auch Nachforschungen im Internet waren leider ergebnislos.
Nun wende ich mich an Sie und hoffe, Sie können meinen Kindern und mir helfen.
Besten Dank im Voraus.
A: Das macht man so: Der Docht der Kerze wird mit frischem feinen Magnesiumpulver (oder
mit frisch gefeilten Spänen) eingerieben. Dann wird er so lange mit Wachs beschichtet, bis man eine schöne Kerze hat.
Wenn Sie diese Kerze anzünden, dann brennt sie erst einmal ganz normal. Allerdings „flickert“ sie ab und zu kurzfristig, wenn sich Magnesiumspäne entzünden. Wichtig: Die Kerze erst mal „einbrennen“ lassen. Dann pusten Sie die Kerze aus. Der Docht glimmt bekanntlich nach – und diese Glut entzündet das Magnesium. Das setzt den Docht wieder in Brand.
Solch eine Kerze können Sie mit Ihren Kindern selber zaubern. Z. B. mit den Resten einer ausgedienten Opferanode. Vorsicht aber beim Schmelzen von Wachs!