 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1771
F: Vielen Dank im Voraus! Ich weiß es sehr zu schätzen, wie viel Zeit Sie in die
Bearbeitung von Fragen stecken.
Ich habe eine Frage zu einem aktuellen Thema und würde mich sehr freuen wenn Sie mir weiterhelfen könnten. Es handelt sich um das Fischsterben, das man beobachtet hat, als protestierende Milchbauern die Milch in Oberflächengewässer entsorgt haben.
Zu einem Fischsterben kommt es ja aufgrund des verminderten O2-Gehalts im Wasser, da Fische ja O2 zur Atmung benötigen! Meine Frage ist jetzt: wieso senkt Milch den O2-Gehalt?
Ich habe 2 mögliche Theorien:
1.) Milch ist ein besserer Nährstofflieferant für Algen als Wasser. Dadurch kommt es zu einer verstärkten Algenbildung
und zu einem höheren O2-Verbrauch durch die Algen nachts. Woraufhin die O2-Konz. absinkt.
2.) Durch die hohe Konz. an gelösten Teilchen in der Milch nimmt die O2-Löslichkeit ab und es kommt quasi
zu einem "Aussalzeffekt" und O2 entweicht? Woraufhin die O2-Konz sinkt.
Über eine Antwort von Ihnen würde ich mich sehr freuen! Mit freundlichen Grüssen ein Fan ihrer Websites...
A: Die Effekte, die Sie beschreiben, stellen sich - wenn überhaupt - erst
langsam ein und erklären nicht das beobachtete rasche Absterben. Auch den Sauerstoffverbrauch durch den mikrobiologischen
Abbau der Milch kann man vernachlässigen.
Die Antwort ist viel einfacher: Die fettreiche Milchemulsion „versifft“ die Kiemen der Fische, so dass der Luftaustausch zwischen Wasser und Blut nicht mehr funktioniert. Die Fische ersticken rasch.
1772
F: Ich würde gerne wissen, warum sich das Gummi eines Luftballons erwärmt, wenn
man es spannt!
A: Am besten kann man das fühlen, wenn man das Gummi unter Berührung der Wange dehnt.
Das Dehnen des Ballons (oder eines roten Labor-Gummischlauchs) bedeutet Energiezufuhr. Diese Energie muss ja irgendwo bleiben.
Gummi besteht aus langen, verknäulten Kettenmolekülen. (Hier berichten wir über den molekularen Aufbau von Gummi.) Die langen Moleküle sind durch van der Waals-Bindungen untereinander verknüpft und dazu noch stark verknäult. Hinzu kommen Quervernetzungen durch Schwefelbrücken.
Die Moleküle haben also einen starken Kontakt miteinander. Wenn man diese Bindungen unter Energiezufuhr auseinander zieht, lösen sich die Molekülketten voneinander, dehnen sich dabei noch und fangen an, wie Saiten zu schwingen. Das empfinden wir als Wärme. Wenn man anschließend das Gummi sich entspannen lässt, werden vor allem die van der Waals-Bindungen erneut geknüpft. Dadurch wird fast die gesamte hineingesteckte Energie als Wärme frei.
Folglich wird das Gummi durch mehrmaliges Dehnen immer heißer. Aber auch das Walken von Gummi wirkt so: So heizen sich die Autoreifen bei der Fahrt stark auf.
1773
F: Auch auf die Gefahr hin, dass ich nun auf ihrer Kuriositätenliste erscheine, möchte
ich gerne eine Kinderfrage meiner Erstklässler an sie weiterleiten: Ist es möglich Kakao (Milch + Kakaopulver) und Milch wieder
zu trennen? Also aus Kakao wieder Milch zu machen?
Ich finde die Frage sehr interessant und könnte mir vorstellen sie als Aufhänger für eine Unterrichtsreihe zum Trennen von verschiedenen Stoffen zu machen. Mit Tinte und Wasser geht es ja mit Hilfe von Kohletabletten :-)
A: Mit dieser Frage landen Sie auf keinen Fall auf der Kuriositätenliste, sondern
in der Frage/Antwort-Rubrik!
Wir können Milch und Kakaopulver nicht mehr voneinander trennen, weil sie chemisch zu ähnliche Substanzen enthalten. So mischen sich die Fette des Kakaos („Kakaobutter“) mit denen der Milch und umgekehrt. Aber auch die Proteine (Eiweiße) vermengen sich und „schließen sich zusammen“. Man kann höchstens durch kompliziertere chemische Eingriffe bestimmte Inhaltsstoffe des Kakaopulvers wie Theobromin oder Serotoninvorstufen herausholen. Das war´s aber schon.
Man kann nur Stoffe voneinander trennen, die physikalisch oder chemisch große Unterschiede zeigen.
Sie haben wohl eine clevere Klasse!
1774
F: Können Sie mir erklären, warum die Knallbüchse diesen tiefer werdenden Brummton
vor der Explosion erzeugt?
A: Die Knallbüchse ist eine unten offene Konservendose, die mit
Wasserstoffgas gefüllt ist. Oben befindet sich ein kleines Loch, an dem das Gas entzündet wird. Nach kurzer Zeit hört man ein
Brummen, dann ein Pfeifen und schließlich gibt es einen Knall. Dann fliegt die Dose in einem hohen Bogen weg.
Wenn die Flamme am oberen Loch brennt, saugt sie Wasserstoffgas aus der Dose. Zum Ausgleich strömt Luft von außen durch den schmalen Spalt zwischen Dosenboden und Unterlage rasch nach. Dadurch beginnt die Dose zu schwingen. Das äußert sich als hörbares Brummen. Wenn dann immer schneller Gas nachströmt, hört man sogar ein Pfeifen. Vergleichen Sie es meinetwegen mit einer Orgelpfeife.
Sobald in der Dose eine zündfähige Mischung aus Luft und Wasserstoff erreicht ist, schlägt die Flamme von oben her durchs kleine Loch nach innen durch. Die Mischung explodiert mit lautem Knall; der Druck treibt die Dose raketenartig hoch.
1775
F: Ich bin vor ein paar Tagen auf Ihre Seite gestoßen und habe mich dort umgesehen.
Mir gefällt die Art, wie Sie Chemie erklären. (Genug der Schleimerei.) Nun aber zu meiner Frage:
Kann man die Schmelztemperaturen von reinen Metallen (ohne Verunreinigung) abschätzen? Gibt es Kriterien wo auf den
„ersten Blick“ ersichtlich wird welches die höhere bzw. niedrigere Schmelztemperatur hat, z. B. Platin, Silber, Zinn oder Blei.
A: Man kann zumindest vergleichend abschätzen.
Man muss sich erinnern, wie die Kristallgitter von Metallen aufgebaut sind: Die Metallatome bilden Ionen („Atomrümpfe“), die durch delokalisierte Elektronen zusammengehalten werden.
Der Schmelzpunkt ist vor allem eine Frage der Anzahl der delokalisierten Elektronen pro Metallatom. Im Allgemeinen nehmen die Schmelzpunkte von den Alkalimetallen bis zu den mittleren Nebengruppenelementen steil zu, um dann wieder abzufallen. So ist es besonders deutlich in der 6. Periode des PSE zu erkennen.
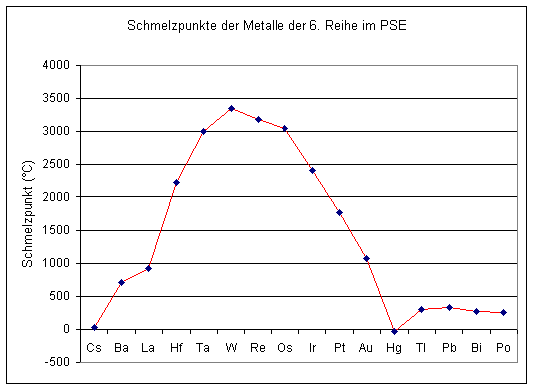
Das Maximum aller Metalle liegt mit 3350 °C beim Wolfram, das Minimum mit -39 °C beim Quecksilber.
Der Kurvenverlauf entspricht übrigens in etwa dem der Metalldichte.
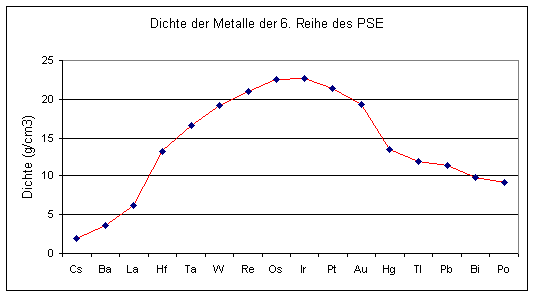
Es sind jedoch hinsichtlich der Dichtewerte und den Schmelzpunkten noch weitere Kriterien zu beachten: