
Lösung von C60 in Toluol (c = 3 mg / 10 ml )
(Foto: Daggi)

Lösung von C60 in Toluol (c = 3 mg / 10 ml )
(Foto: Daggi)
Einordnung des Themas Fullerene in den Chemieunterricht
Experimente:
Versuch: Löslichkeitsverhalten der Kohlenstoffmodifikationen
Fullerene und ihre Chemie können im Chemieunterricht an verschiedenen Stellen behandelt
werden.
A) Sekundarstufe [1,2]
| 1) | Im Rahmen des Themas "Modifikationen des Kohlenstoffs" werden die Fullerene als dritte Modifikation behandelt. Auf dieser Stufe sind auch schon erste einfache Experimente möglich, die die Unterschiede der drei Kohlenstoff-Modifikationen Graphit, Diamant und Fulleren zeigen. Dies sollte auch im Rahmen des Themas "Der atomare/molekulare Aufbau der Stoffe ist Grundlage für ihre Eigenschaften" geschehen. Aus diesen Experimenten können die Schüler nämlich auf Größe und Bindung der Moleküle schließen. Eine Schulbuchseite zeigt dies exemplarisch [3]. |
| Mögliche Aufgaben hierzu: |
|
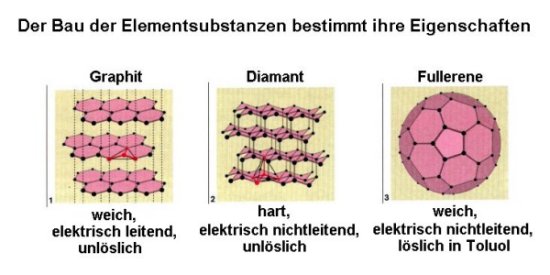
Da man mit den Fullerenen organisch-chemische Reaktionen durchführen kann, ist es möglich, im Anschluss an die Behandlung der Fullerene direkt in die organische Chemie einzusteigen.
| 2) |
Bei der propädeutischen Einführung der organischen Chemie kann
mit Hilfe der Fullerene eine Vertiefung der Alkenchemie erfolgen.
Will man im Anschluss an die organische Chemie, wie dies in einigen
Bundesländern wie z. B. Baden-Württemberg üblich ist, den Kohlenstoff und seine
anorganischen Verbindungen behandeln, eignen sich die Fullerene sehr gut
als Übergang. Sie verhalten sich wie Kohlenwasserstoffe, denen die
Wasserstoffatome fehlen.
An dieser Stelle ergibt sich ein kleines Problem, das man mit den
Schülern diskutieren sollte:
|
B) Sekundarstufe II [4,5]
| 1) |
Im Rahmen der Sekundarstufe II bietet es sich in besonderer Weise an,
die Fullerene und ihre Chemie in der Reihe "Chemie der Alkene" zu
behandeln. Dabei können die Fullerene sowohl am
Anfang als auch am Ende einer solchen Reihe stehen. Es ist durchaus
möglich über die Fullerene den Einstieg in die Alkenchemie zu
machen, da die typischen Alkenreaktionen (z. B. Additionen
und Cycloadditionen) mit ihnen einfach durchzuführen sind. Hierbei
bieten die Fullerene gegenüber den meisten anderen Alkenen, die
normalerweise im Schulunterricht verwendet werden, deutliche Vorteile.
Auf der einen Seite sind ihre Lösungen farbig und sie zeigen bei
chemischen Reaktionen deutliche Farbänderungen. Diese sind für
jede Reaktion zwar ähnlich, aber im Vergleich unterschiedlich. In
der Schule können Schüler und Lehrer die Farbänderungen
visuell verfolgen. Zum Vergleich ist es deshalb hilfreich, als Farbstandard
C60 im jeweiligen Lösungsmittel zur Hand zu haben. Falls
ein UV/Vis-Spektrometer vorhanden ist, können auch fotometrische
Untersuchungen durchgeführt werden. Darüber hinaus sind mit
Fullerenen auch solche Reaktionen möglich, die sich mit den in der
Schule normalerweise benutzten Alkenen nur schwer realisieren lassen,
z. B. die Hydrierung.
Es besteht natürlich auch die Möglichkeit, nur bestimmte
Aspekte der Fullerenchemie in eine Unterrichtseinheit über Alkene
zu integrieren. Auf diese Weise erhält man eine Mischung von "farbiger"
und "farbloser" Alkenchemie.
|
| 2) | Des Weiteren können die Fullerene auch für eine vergleichende Betrachtung der Stoffklasse der Alkene mit der der Aromaten herangezogen werden. Man könnte das C60-Buckminsterfulleren aufgrund seiner polycyclischen Struktur und der vielen Benzolringe auch als einen polykondensierten Aromaten betrachten. Dagegen spricht aber zum einen das chemische Reaktionsverhalten, das die Schüler in Experimenten untersuchen und mit dem anderer Aromaten und Alkene vergleichen können. Andererseits kann das Problem auch von der theoretischen Seite her angegangen werden. C60 gehorcht nicht der Hückel-Regel und wegen der kugeligen Struktur ist das pi-Elektronensystem nicht planar. Anhand einer solchen Reihe kann der typische Weg der naturwissenschaftlichen Erkenntnisgewinnung aufgezeigt werden (Hypothesenbildung, Verifikation bzw. Falsifikation derselben, Suchen einer theoretischen Erklärung). |
| 3) | Unabhängig von den typischen Alkenreaktionen ist es möglich, bestimmte Aspekte der Fullerenchemie auch an anderen Stellen im Unterricht zu behandeln. Die Isolierung der Fullerene aus fullerenhaltigem Ruß mit anschließender chromatographischer Trennung zur Gewinnung von reinem C60-Buckminsterfulleren lässt sich problemlos in das Themengebiet "Analytische Chemie" integrieren. Hierbei kann es sehr motivierend sein, dass die Schüler im Unterricht selbst den vollständigen Trennungsgang vom fullerithaltigem Ruß bis zur magentafarbenen Lösung des reinen C60 durchführen. Die dabei verwendeten Geräte wie Destillationsbrücke, Chromatographiesäule und Soxhletextraktor sind etwas nicht alltägliches im Chemieunterricht und steigern sicher das Interesse der Schüler. |
| 4) | Die Bildung von Donator-Akzeptor-Komplexen zwischen C60 und elektronenreichen Verbindungen wie Hexamethylbenzol oder Dimethoxybenzol kann auch bei der Behandlung des chemischen Gleichgewichts durchgeführt werden. Sie stellen eine gute Ergänzung oder Ersatz der "klassischen" Versuche (Chromat/Dichromat- oder Anthracen/Pikrinsäure- Gleichgewicht) dar, bei denen zum Teil mit Substanzen gearbeitet wird, die im Verdacht stehen, krebserregend zu sein. Das Gleichgewicht bei der Komplexbildung lässt sich wie bei den bekannten Reaktionen auf einfache Weise durch Konzentrationsänderung verschieben. |
| 5) | Anhand der Entdeckung der Fullerene können verschiedene Hybridisierungsarten besprochen werden. |
Bisher waren vom Kohlenstoff bekannt:
|
|
| Kroto, Smalley u.a. waren bei der Entdeckung der Fullerene eigentlich auf der Suche nach poly-sp-Systemen, den kettenförmigen Polyinen. |
| 6) | Die Eignung der Fullerene als Gegenstand eines fächerübergreifenden Unterrichts wird in einer eigenen Webseite untersucht. |
| Literatur |
| [1] | A. Hildebrand, U. Hilgers und R. Blume, Die dritte Modifikation des Kohlenstoffs. Fullerenchemie in der Sekundarstufe I; NiU-Chemie 7/33 (1996), 41-45. |
| [2] | A. Höner, Fullerenchemie in der Sekundarstufe I. 1. Staatsexamensarbeit, Fakultät für Chemie, Universität Bielefeld 1996. |
| [3] | a) Chemie für Gymnasien, Sachsen (Klasse 8), Cornelsen-Verlag, Berlin 1997.
b) Chemie für Gymnasien, Baden-Württemberg 3 (Klasse 11), Cornelsen-Verlag, Berlin 1997. |
| [4] | U. Hilgers, A. Hildebrand und R. Blume, Fullerene im Unterricht. Möglichkeiten zur Behandlung eines aktuellen Forschungsgebietes; Chem. Sch. 42 (1995), 447-452. |
| [5] | A. Schalk-Trietchen, Fullerene. Ein fächerübergreifendes Thema für die Sekundarstufe II. 1. Staatsexamensarbeit, Fakultät für Chemie, Universität Bielefeld 1996. |
Weitere Texte zum Thema „Fullerene“