Versuch: Substitution der Thermolyse von Quecksilberoxid
Schülerversuch; Zeitbedarf für die Thermolyse: 5 min, für die Darstellung des Silberoxids benötigt man ca. 20 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Besondere Hinweise
Die folgende Versuchsgruppe verdeutlicht sehr gut die Substitution von giftigen Stoffen
durch ungiftige sowie das Recycling zur Schonung von Rohstoffquellen, wobei man
erfährt, dass dies auch ein bisschen unbequem sein kann.
Die Synthese von Silberoxid sollte deshalb nicht vom Chemielehrer in seiner Freizeit,
sondern im Rahmen des Chemieunterrichts von älteren Schülern durchgeführt werden.
Sachanalyse
Die thermische Reduktion von Metalloxiden setzt eine geringe Oxidationswärme bei
der Bildung des entsprechenden Oxids voraus, z. B.:
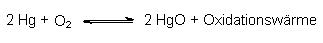
Ist diese Wärme so gering, dass sie auch von einem Bunsenbrenner aufgebracht
werden kann, so lässt sich das Gleichgewicht nach links verschieben. Untersucht man
die gängigen Metalle, so findet man, dass die Grenze beim Quecksilber liegt. Auf
thermischem Wege lassen sich unedlere Metalle nicht mehr aus ihren Oxiden
austreiben, wohl aber edlere Metalle.
Wegen der Giftigkeit von Quecksilber und der mit der Thermolyse verbundenen
Kontamination sollte man deshalb auf das ungiftige Silberoxid Ag2O zurückgreifen:
Ag2O + Oxidationswärme ———> 2 Ag + ½ O2
Leider ist diese Reaktion nicht mehr reversibel, da die Aktivierungsenergie höher als
die Oxidationsenergie ist und die Bildung des Oxids damit zugunsten der Thermolyse
zurückgedrängt wird.
Man muss deshalb das Oxid auf anderem Wege herstellen. Hierzu lässt man
zunächst Silbernitrat mit Natronlauge reagieren:
Ag+ + OH¯ ———> AgOH
Das braune Silberhydroxid wird durch schwaches Erwärmen entwässert. Dabei bildet
sich weitgehend Silberoxid Ag2O.
(Allerdings kann man mit diesem selbsthergestellten Oxid nicht quantitativ arbeiten, da
der Wassergehalt je nach Trocknungsgrad wechselt. Das gilt nicht für das käufliche Oxid.)
Geräte
Reagenzgläser, Trockenschrank, Filtriervorrichtung.
Chemikalien
Silbernitrat (Xi), Natronlauge (c » 2 mol/l) (Xi),
konzentrierte Salpetersäure (C).
Durchführung
A. Darstellung von Silberoxid
Versetze eine konzentrierte Lösung von Silbernitrat mit überschüssiger
Natronlauge, warte kurz und filtriere dann durch einen möglichst kleines Filterpapier.
(Am Besten setzt man eine kleine Nutsche mit Saugfinger ein, da Filterpapier Silbersalze stark
adsorbiert.) Der Niederschlag wird mehrmals gewaschen und anschließend im
Trockenschrank einige Stunden bei nicht mehr als 100 ºC entwässert. Das
schwarzbraune Pulver wird in eine dunkle Flasche gegeben.
B. Thermolyse von Silberoxid
Erhitze eine Probe des Oxids und fange das gebildete Gas über Wasser auf. Mit dem
Glimmspan weist du Sauerstoff nach. Im Reagenzglas bleibt weißes, glänzendes
Silbermetall zurück.
C. Recycling von Silberoxid (Schutzbrille!)
Das freigesetzte Silber wird mit möglichst wenig konzentrierter, farbloser
Salpetersäure gelöst (Abzug!), die erhaltene Silbernitratlösung mit Natronlauge versetzt
(Vorsicht!). Es bildet sich wieder Silberhydroxid, welches wie in Abschnitt A beschrieben
aufgearbeitet wird.