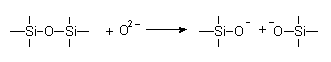
Der chemische Vorgang bei der Glasbildung
Experimente:
Versuch: Auflösen von Glaspulver durch Alkalien; Nachweis von Siliciumdioxid
Das übliche Glas ist ein Salz der Kieselsäure (siehe Experimente,
V 13).
Vereinfacht kann man die Bildung von Glas als Bildung eines Salzes aus Nichtmetalloxid
und Metalloxid auffassen:
SiO2 + CaO ————> CaSiO3
Denn Quarz ist ein Säureanhydrid, das in einer ganz normalen Säure/Base-Reaktion mit
basischen Oxiden wie CaO oder Na2O Salze (Silicate) bildet.
(Der Vergleich mit den Salzen der Kohlensäure liegt nahe. Kohlenstoff ist ja im PSE
ein Element der gleichen Gruppe wie Silicium. Allerdings bildet Siliciumdioxid bei
Zimmertemperatur makromolekulare Gitter und ist daher fest, während Kohlenstoffdioxid aus
einzelnen Molekülen besteht und gasförmig ist.)
Geht man von den Carbonaten aus, so kann man auch sagen, dass es sich bei dieser
Säure/Base-Reaktion um den Austausch von Säureanhydriden handelt:
CaCO3 + SiO2 ————> CaSiO3 + CO2
Im Einzelnen geschieht bei der Glasherstellung Folgendes: Bei den hohen Temperaturen werden die Alkali- und Erdalkalicarbonate zersetzt und die entsprechenden Metalloxide gebildet. In der Schmelze werden die Sauerstoff-Ionen der Oxide freigesetzt; sie brechen das Quarzgitter auf.
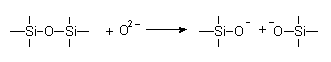
Die entstandenen negativen Ladungen werden durch die Metall-Ionen ausgeglichen:
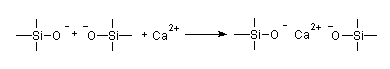
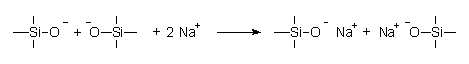
Es bilden sich regellose Strukturen mit vielen Trennstellen. Die Folge ist der niedrige und weite Erweichungsbereich dieses Glastyps (Kalk-Natron-Glas) um 600 °C.
Weitere Texte zum Thema „Glas“