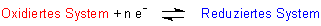
Die Nernstschen Gleichungen für das Wasserstoffperoxid-Redoxsystem
Experimente:
Versuchsgruppe: Wasserstoffperoxid - auch ein Reduktionsmittel?
In einer Webseite haben wir beschrieben, dass Wasserstoffperoxid
in seinem Redoxverhalten „amphoter“ ist. Denn je nach Reaktionspartner wirkt es als Oxidationsmittel (gegenüber
Reduktionsmitteln) und in (einigen wenigen Fällen) auch als Reduktionsmittel (gegenüber starken
Oxidationsmitteln).
An diesen beiden Systemen wollen wir das Aufstellen der Nernstschen Gleichung üben.
Allgemeines zur Nernstschen Gleichung
Gegeben sei ein beliebiges Redox-Gleichgewicht:
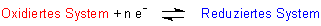
Die chemischen Symbole für das oxidierte System bezeichnen wir rot, die des reduzierten Systems blau.
Die Nernstsche Gleichung für eine entsprechende Halbzelle lautet

Statt mit Konzentrationen sollte man besser mit den dimensionslosen Aktivitäten arbeiten. Wir erklären das am Beispiel des Bleiakkus.
Das Wasserstoffperoxidsystem
Zur Formulierung der Redoxgleichungen des Wasserstoffperoxidsystems sei darauf hingewiesen, dass sich nur die
Oxidationszahlen des Sauerstoffs ändern. Wasserstoff hat immer die Oxidationszahl (+1).
1 Wasserstoffperoxid ist Oxidationsmittel
Reaktionsgleichung der H2O2-Reduktion:
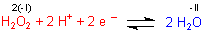
Daraus folgt für die Nernstsche Gleichung:
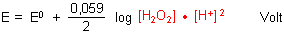
Wir berücksichtigen die Konzentration (besser: Aktivität) des Wassers nicht weiter, da sie als konstant anzunehmen ist.
Mit der bekannten Definition des pH-Werts
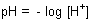
sieht die Nernstsche Gleichung für die oxidierende Wirkung von Wasserstoffperoxid so aus:
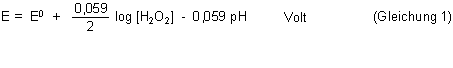
Die Standardpotentiale sind vom pH-Wert abhängig:
E0 (bei pH 0) = +1,76 V
E0 (bei pH 14) = +0,867 V
(Wenn man E0 (bei pH 14) mit Hilfe der Gleichung (1) aus E0 (bei pH 0) berechnen will, gibt es eine kleine Abweichung. Das liegt u. a. daran, dass H2O2 eine schwache Säure ist und Anionen ein anderes Redoxpotential aufweisen als die undissoziierte Säure.)
Der Gleichung (1) entnehmen wir:
Mit steigender H+-Ionenkonzentration, also mit sinkendem pH-Wert,
- steigt gegenüber Reduktionsmitteln das Potential der Wasserstoffperoxid-Halbzelle,
- nimmt die Oxidationskraft von H2O2 gegenüber Reduktionsmitteln zu.
Das Gleiche gilt für steigende Konzentrationen an Wasserstoffperoxid.
Reaktionsbeispiele:
PbS zu PbSO4
Fe(II) zu Fe(III)
Mn(II) zu MnO2
H2S zu S
H2SO3 zu H2SO4
2 Wasserstoffperoxid ist Reduktionsmittel
Reaktionsgleichung der H2O2-Oxidation:
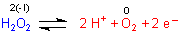
Daraus folgt für die Nernstsche Gleichung:
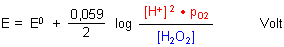
Wir berücksichtigen die Konzentration des Sauerstoffs, die man im Allgemeinen als Partialdruck pO2 angibt, nicht weiter, da sie wegen des Gasaustauschs zwischen Lösung und Luft als konstant anzunehmen ist.
Auch hier führen wir den pH-Wert ein und erhalten die Nernstsche Gleichung für die reduzierende Wirkung von Wasserstoffperoxid:
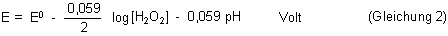
Auch hier sind die Standardpotentiale vom pH-Wert abhängig:
E0 (bei pH 0) = +0,682 V
E0 (bei pH 14) = -0,076 V
(… und auch hier gibt es bei der Berechnung von E0 (bei pH 14) aus E0 (bei pH 0) mit der Gleichung (2) eine kleine Abweichung.)
Der Gleichung (2) entnehmen wir:
Mit abnehmender H+-Ionenkonzentration, also mit steigendem pH-Wert,
- sinkt gegenüber Oxidationsmitteln das Potential der Wasserstoffperoxid-Halbzelle,
- nimmt die Reduktionskraft von H2O2 gegenüber Oxidationsmitteln zu.
Das Gleiche gilt für steigende Konzentrationen an Wasserstoffperoxid.
Reaktionsbeispiel:
KMnO4 zu Mn(IV) bzw. Mn(II)
Ein Vergleich mit Bekanntem: Sauerstoff- und Wasserstoffelektrode
Wenn man genau hinsieht, handelt es sich bei den Wasserstoffperoxid-Halbzellen um Varianten der Sauerstoff- und
Wasserstoffelektroden. Das macht auch die Graphik deutlich, in der wir das jeweilige Halbzellenpotential gegen den
pH-Wert auftragen.
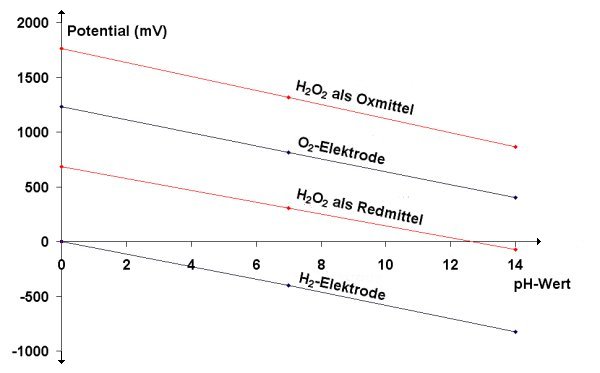
Potential-pH-Kurven des Wassersystems (schwarz) und des Wasserstoffperoxidsystems (rot)
Was ist die chemische Erklärung für die Verschiebung der Kurven des Wasserstoffperoxidsystems gegenüber denen des Wassersystems?
H2O2 nimmt eher Elektronen auf als Sauerstoff. Das liegt u. a. daran, dass es leicht in zwei Hydroxyl-Radikale zerfällt. Diese wirken als starke Elektronenakzeptoren.
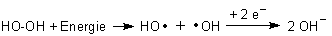
Aus dem gleichen Grund gibt H2O2 weniger gern Elektronen ab als Wasserstoff. Dass es überhaupt Elektronen abgibt, liegt daran, dass sich – energiebegünstigt - bei deren Abzug sofort das Sauerstoffmolekül bildet.
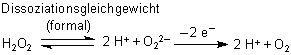
Weitere Texte zum Thema „Wasserstoffperoxid“