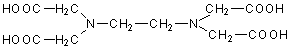
|
Messung der Wasserhärte, Maßeinheiten
Experimente
Versuch: Vorgehensweise bei der komplexometrischen Titration
Ermittlung der Gesamtwasserhärte
Das kann man zwar leicht durch Eintauchen von Stäbchen ("Sticks") machen, die mit
Chemikalien beschichtet sind. Viel genauer ist es jedoch, wenn wir die Wasserhärte
durch komplexometrische Titration mit Titriplex III, dem Dinatriumsalz von EDTA
bestimmen (siehe Experimente, V 3). Der Ca2+/EDTA-Komplex
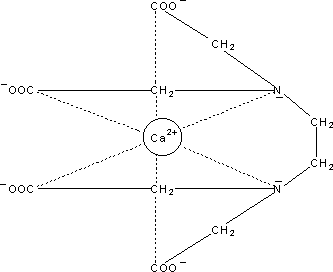
ist ein 1:1-Chelat. (EDTA hat sechs Bindungsstellen, daher resultiert eine oktaedrische
Anordnung; siehe Bild 1.)
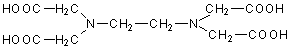
|
|
Bild 1: EDTA (oben) und EDTA-Ca-Komplex
Das alte Maß für die Wasserhärte, der deutsche Härtegrad °dH, entspricht jeweils in einem Liter Wasser
1 °dH = 10,0 mg CaO /l = 7,19 mg MgO /l
Die Wasserhärte wird heute in mmol Erdalkali-Ionen/l Wasser angegeben. Wir schreiben für die Erdalkalimetall-Ionen Ca2+.
1 °dH = 0,179 mmol Ca2+ /l oder 1 mmol Ca2+ /l = 5,608 °dH
Da sich bei der Titration mit EDTA ein 1:1-Komplex bildet, gilt:
1 ml EDTA (c = 0,1 mol/l) = 0,5608 °dH = 0,1 mmol Ca2+ /l
Bei der Titration zur Wasserhärtebestimmung könnte man 1 l Wasser vorlegen. Dann braucht man viel Zeit zum Titrieren, und man braucht auch viel EDTA. Üblicherweise legt man deshalb nur 100 ml Wasser vor. Zur Erhöhung der Titriergenauigkeit arbeitet man dann auch mit zehnfach verdünnter EDTA-Lösung (nämlich c = 0,01 mol/l). Das hebt sich bei der Berechnung der Wasserhärte aus den Titrationsdaten auf. Nur unter diesen Bedingungen entspricht 1 ml EDTA-Lösung mit der Konzentration c = 0,01 mol/l der Wasserhärte 0,5608 °dH bzw. 0,1 mmol Ca2+/l.
Wir bleiben am besten bei den Härtegraden, denn diese sind immer noch gebräuchlich, wenn es um die Einteilung des Wassers nach Härtebereichen oder um medizinische Beurteilungen geht:
| 0-7 ° | weiches Wasser | (Härtebereich I) | |
| > | 7-14 ° | mittelhartes Wasser | (Härtebereich II) |
| > | 14-21 ° | hartes Wasser | (Härtebereich III) |
| > | 21 ° | sehr hartes Wasser | (Härtebereich IV) |
Die genauen Werte der Wasserhärte des Bereichs, aus dem du Proben nimmst, bekommst du von den Stadtwerken. Damit kannst du deine Messungen überprüfen. Notwendig ist aber, dass du das Wasser, das über Nacht in der Leitung gestanden hat, vor der Probennahme auslaufen lässt, da sich dieses oftmals mit zweiwertigen Ionen aus Ablagerungen oder aus dem Rohrmaterial (Kupfer oder Blei!) gesättigt hat und deshalb zu hohe Härtewerte vorgetäuscht werden. Das gilt besonders für Wasser aus den oftmals wenig genutzten Leitungen des Schullabors!
Getrennte Ermittlung der Carbonatwasserhärte (Carbonathärte)
Will man die Carbonathärte getrennt bestimmen, so muss man die Konzentration von Hydrogencarbonat durch
Verdrängungstitration mit Salzsäure bestimmen.
Ca(HCO3)2 + 2 HCl ———> CaCl2 + 2 H2O + 2 CO2
1 mol Salzsäure bedeutete 0,5 mol Calcium. Bei diesem für Ungeübte etwas schwierigen, weil stufenweisen Titrations-Verfahren benötigt man mehrere Indikatoren: Phenolphthalein und eine Mischung aus Methylorange und Methylenblau B („Mischindikator“).
Letztlich geht auch die Definition des deutschen Härtegrads auf die Bestimmung der Carbonathärte zurück. Man bestimmte die Härte früher gravimetrisch: Dazu erhitzte man das Wasser, ohne dass es verdampfte, wobei sich Calciumhydrogencarbonat zersetzte und Kalkstein bildete:
Ca(HCO3)2 + Energie ———> CaCO3 + H2O
Der Kalkstein wurde abgetrennt, geglüht und als CaO gravimetrisch bestimmt.
CaCO3 + Energie ———> CaO + CO2
Man definierte einfach 10,0 mg CaO als 1 °dH.
Andere Maßeinheiten zur Wasserhärte
Für die Beschreibung der Wasserhärte gibt es international keinen Standard, es sei denn, man besinnt sich der
für einen Chemiker einzig vernünftigen Angabe in mol/l bzw. mmol/l.
1 °dH entspricht 0,18 mmol/l an Erdalkali-Ionen
Zu den genauen chemischen Abläufen bei der komplexometrischen Titration, zur Rolle des Indikators und zur Erklärung seiner Farbänderungen klicke hier.
Weitere Texte zum Thema „Wasserhärte“