|
|
 |
 |
 |
|
|
|
|
Kaliumhexa- cyanoferrat-(III), Schwefel (S) |
Physikalische Eigenschaften von Stoffen
I. Subjektive Stoffeigenschaften
II. Objektive Stoffeigenschaften
Mit Hilfe der physikalischen Stoffeigenschaften lassen sich die verschiedenen Stoffe beschreiben und zuordnen und deren Verhalten bei unterschiedlichen Bedingungen erklären. So ist z. B. die Kenntnis bestimmter Stoffeigenschaften notwendig, um verschiedene Stoffe unterscheiden zu können (Stofferkennung) und die Prinzipien der Trennung von Stoffgemischen (Stofftrennung) zu verstehen. Die Eigenschaften lassen sich in zwei Gruppen einteilen.
I. Subjektive Stoffeigenschaften
Subjektive Eigenschaften sind sensorisch erfassbar
(mit den Sinnen wahrnehmbar) und hängen damit vom Eindruck des Beobachters ab.
Farbe (Glanz)
Jeder Stoff besitzt eine charakteristische Farbe. Diese kann zur vorläufigen
Identifizierung eines Stoffes dienen. Dennoch können sehr unterschiedliche Stoffe
auch ähnliche Farben besitzen. So besitzen z. B. reines Calciumcarbonat (Kalk),
Calciumsulfat (Gips), Natriumcarbonat (Soda), Natriumchlorid (Kochsalz) und viele
andere Stoffe eine weiße Farbe. Um sie zu unterscheiden, müssen andere,
objektive Stoffeigenschaften hinzugezogen werden.
Besonders auffällig sind die geringen Farbunterschiede bei den Metallen. Sie
sind mit wenigen Ausnahmen, wie z. B. Kupfer, silbrig glänzend. Deshalb spricht
man bei den Metallen auch vom metallischen Glanz.
Viele Gase (z. B. Sauerstoff, Kohlendioxid und Stickstoff) besitzen überhaupt
keine Farbe; es sind farblose Gase. Auch sie müssen über objektive
Stoffeigenschaften unterschieden werden.
Härte
Die Bestimmung der Härte eines Stoffes hängt natürlich im
Wesentlichen auch davon ab, wie der vorliegende Stoff verarbeitet ist und in welcher
Form er vorliegt. Vergleicht man z. B. die Biegsamkeit zweier Bleche unterschiedlicher
Metalle, so müssen beide Bleche die gleiche Schichtdicke besitzen. Aufgrund
ungeeigneter Formen, z. B. wenn der Stoff in pulverisierter oder feinkristalliner
Form vorliegt (Kochsalz, Puderzucker, gemahlener Mamor, etc.), lässt sich
die Härte mancher Stoffe nur schwer oder überhaupt nicht bestimmen.
Geruch
Um den Geruch eines Stoffes oder Stoffgemisches zu bestimmen, muss der
Stoff selbst bzw. mindestens eine Stoffkomponente des Gemisches bei Raumtemperatur
beginnen zu verdunsten. So besitzen z. B. Früchte aufgrund leichtflüchtiger
Aromastoffe oder Erdöl aufgrund leichtflüchtiger Verbindungen charakteristische
Gerüche.
Geruchsproben müssen aufgrund der Gefährlichkeit mancher Stoffe
(Gefahr des Vergiftens oder Verätzens) immer durch vorsichtiges
Zufächeln mit der Hand durchgeführt werden!
Geschmack
Geschmacksproben sind bei chemischen Untersuchungen generell
nicht zulässig. Dennoch kennen wir z. B. von Lebensmitteln unterschiedliche
Geschmacksrichtungen. Die Nervenzellen unserer Zunge sind in der Lage die vier grundlegenden
Geschmacksrichtungen (bitter, salzig, süß und sauer) zu erkennen. Die Vielzahl
weiterer Geschmacksrichtungen (Geschmacksfarben) basiert der Reaktion von Aromen mit der Nasenschleimhaut.
II. Objektive Stoffeigenschaften
Objektive Stoffeigenschaften sind im Gegensatz zu den subjektiven Eigenschaften messbar.
Löslichkeit
Die Bestimmung der Löslichkeit eines Stoffes hängt vom chemischen
Aufbau des Stoffes und dem des gewählten Lösungsmittels ab. Hierbei lösen
sich geladene (polare) Stoffe gut in ebenfalls polaren Lösungsmitteln (z. B. Kochsalz
in Wasser) und ungeladene Stoffe in unpolaren Lösungsmitteln (z. B. Schmieröl in
Reinigungsbenzin). Daneben gibt es aber auch Stoffe, die aus geladenen und ungeladenen
Molekülregionen aufgebaut sind. Sie lösen sich sowohl in polaren als auch unpolaren
Lösungsmitteln (z. B. lösen sich Tenside in Wasser und Öl).
Gelöste Stoffe verteilen sich auch ohne Umrühren nach einiger Zeit
gleichmäßig in der Lösung. Dieser Vorgang wird als Diffusion
bezeichnet. Er beruht auf der Eigenbewegung der Moleküle in Flüssigkeiten
aber auch Gasen (Brownsche Bewegung), die durch Erwärmen beschleunigt werden kann.
Versuche:
Temperaturabhängige Extraktion von Tee
Leitfähigkeit von Kochsalz
Ammoniak aus Hirschhornsalz
Löslichkeit von lipophilen Stoffen in Fetten
Untersuchung der Löslichkeit von Speiseöl
Aggregatzustand
Der Aggregatzustand beschreibt, ob ein Stoff bei einer bestimmten Temperatur und
einem bestimmten Druck fest, flüssig oder gasförmig vorliegt. Der Vergleich der
Aggregatzustände verschiedener Stoffe wird in der Regel bei Raumtemperatur (ca. 20 °C)
und Normaldruck (1013 mbar) durchgeführt. So liegt Wasser unter diesen Bedingungen als
Flüssigkeit, Butan (Feuerzeuggas) als Gas vor. Wird Wasser auf 100 °C erhitzt oder Butan
einem starken Druck ausgesetzt, ändern sich die Aggregatzustände: Unter diesen
Bedingungen liegt Wasser als Gas (Wasserdampf) und Butan als Flüssigkeit
(gut in Feuerzeugen zu beobachten) vor.
Schmelz- und Siedepunkt
Jeder Reinstoff besitzt einen messbaren Schmelz- und einen messbaren
Siedepunkt bei einem bestimmten Druck. Diese Punkte, bei denen die Stoffe ihren
Aggregatzustand ändern, werden unter Normaldruck (1013 mbar) gemessen. Die Fixpunkte
von Thermometern mit Celsius-Skala (0 °C - 100 °C) orientieren sich z. B. am Schmelzpunkt (0 °C)
und dem Siedepunkt (100 °C) von Wasser bei Normaldruck. Wenn Feststoffe ihren Schmelzpunkt
erreichen, beginnen sie zu schmelzen (umgekehrt spricht man vom Erstarren einer
Flüssigkeit).
Wird der Siedepunkt von Flüssigkeiten erreicht, nennt man dies
Verdampfen bzw. Verdunsten. Umgekehrt bezeichnet man das Verflüssigen
von Gasen als Kondensieren.
Einige Feststoffe überspringen den flüssigen Aggregatzustand und nehmen ab einer
bestimmten Temperaturerhöhung direkt den gasförmigen Zustand ein; sie
sublimieren. Wenn solche Gase abgekühlt und damit wieder ihren festen
Aggregatzustand einnehmen, nennt man dies resublimieren.
Die Übergänge zwischen den Aggregatzuständen werden als
Aggregatübergangszustände bezeichnet.
Die Schmelz- und Siedepunkte von Stoffgemischen unterscheiden sich von denen
der Reinstoffe.
Dichte
Die Dichte (r : rho) ist eine charakteristische Größe für jeden Stoff. Sie ist der
Quotient aus der Masse (m) und dem Volumen (V) des Stoffes: r
= m / V. Die Einheit der Dichte ist [g / cm3] (Gramm pro Kubikzentimeter)
bzw. für Gase aufgrund deren geringer Dichte [g / l] (Gramm pro Liter).
Zur Bestimmung der Dichte eines Stoffes muss folglich sein Gewicht und das von
ihm eingenommene Volumen gemessen werden.
Versuche:
Dichtebestimmung eines Gases am Beispiel von Feuerzeuggas
Dichtebestimmung von 2-Pfennig-Münzen
Elektrische Leitfähigkeit
Einige Stoffe leiten den elektrischen Strom (z. B. Kupferdrähte in Kabeln),
andere nicht (z. B. Kabelisolierungen aus Kunststoff). Im Bereich der Feststoffe besitzen
nur die Metalle eine gute elektrische Leitfähigkeit.
Reines Wasser ist kein guter Leiter des elektrischen Stroms. Die Lösung von einigen
nicht leitenden Stoffen (z. B. Kochsalz, Essig) in Wasser besitzt dagegen eine gute elektrische
Leitfähigkeit. Andere Stoffe, wie z. B. Zucker, haben dagegen keinen Einfluss auf die
elektrische Leitfähigkeit von Wasser.
Versuche:
Elektrische Leitfähigkeit von Gläsern
Leitfähigkeit von Kochsalz
Wir bestimmen die Leitfähigkeit von Stoffen des Alltags
Magnetismus
Manche Stoffe, wie z. B. Eisen oder Magnetit (Fe3O4) werden
von einem Magneten angezogen, andere (z. B. Kupfer oder Kochsalz) nicht.
Versuche:
Magnetisches Sortieren von 2-Pfennig-Münzen
Magnetischer Sand?
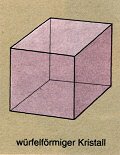
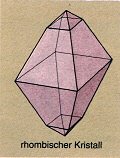
Kristallform
Einige Stoffe, vor allem Salze, besitzen eine charakteristische
Kristallform, anhand derer sie identifiziert werden können. Tabelle 1
zeigt verschiedene Stoffe und deren Kristallformen.
|
|
 |
 |
 |
|
|
|
|
Kaliumhexa- cyanoferrat-(III), Schwefel (S) |
Versuche:
Züchten von Zuckerkristallen
Kristallisation von Magnesiumsulfat
Züchten von Einzelkristallen
Kochsalzkristalle im Eiltempo
Weitere Texte zum Thema „Chemie im und ums Haus“