Versuch: Saure Eigenschaften von Ascorbinsäure (Vitamin C)
Schülerversuch; 10 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Geräte
Reagenzglas.
Chemikalien
Vitamin C (w = 10 %), Magnesiumstreifen, destilliertes Wasser.
Durchführung
In ein Reagenzglas gibt man 5 ml Vitamin C -
Lösung und prüft diese mit einem Universalindikator.
Der Indikator zeigt eine saure Lösung an.
Anschließend gibt man einen 1 cm langen Magnesiumstreifen in die
Lösung und beobachtet.
Beobachtung
Der Magnesiumstreifen löst sich langsam unter Bildung
eines Gases auf.
Auswertung
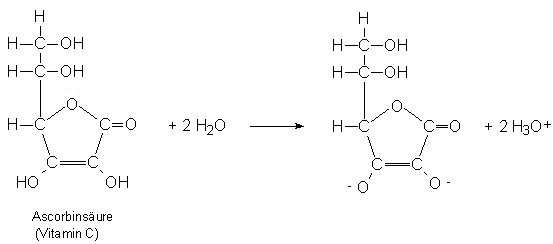
Ascorbinsäure (Vitamin C) ist zwar eine organische
Säure, besitzt aber nicht die für Carbonsäuren
typische Carboxylgruppe (COOH-Gruppe), sondern zwei Hydroxy-Gruppen
(OH-Gruppen), die mit Wasser zu einer sauren Lösung reagieren:

So zeigt auch die Ascorbinsäure die typische Reaktion von Säuren mit unedlen Metallen, wie z. B. mit Magnesium. Es reagiert mit Ascorbinsäure zu Magnesium-Ionen und Wasserstoffgas:
Mg + 2 H3O+ à Mg 2+ + 2 H2O + H2 á
Literatur
H.-P. Haseloff, J. Mauch, Das Vitamin-C-Projekt, Verlag Moritz Diesterweg, Frankfurt a. M. 1989, 41.