Die Henderson-Hasselbalch-Gleichung für Indikatoren
Auf der Seite Wie ein Säure-Base-Indikator "funktioniert" wurde bereits erläutert, dass eine (allgemeine) Indikatorsäure HInd in wässriger Lösung folgendem Protolysegleichgewicht unterliegt:
![]()
Die Lage dieses Protolysegleichgewichtes lässt sich mit Hilfe der Säuredissoziationskonstanten KS beschreiben:
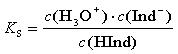
Logarithmiert man nun diese Gleichung und multipliziert man sie mit –1, so erhält man:
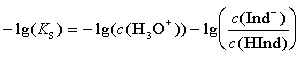
Der negative dekadische Logarithmus der H3O+-Ionen-Konzentration ist aber gerade der pH-Wert. In analoger Weise definiert man den negativen dekadischen Logarithmus der Säuredissoziationskonstanten KS als pKS-Wert. Durch diese beiden abkürzenden Schreibweisen vereinfacht sich obige Gleichung zu:
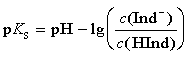
Stellt man diese Gleichung nach dem pH-Wert um, so erhält man die Henderson-Hasselbalch-Gleichung:
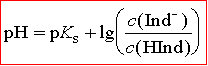
Diese Gleichung kennst du schon von schwachen Säure/Base-Systemen her. Dort wird sie auch
Puffergleichung genannt.
Mit Hilfe der Henderson-Hasselbalch-Gleichung kann nun der Zusammenhang zwischen der Stärke
der Indikatorsäure HInd und der Lage des Umschlagsbereiches quantifiziert werden. Wie auf der
vorangegangenen Seite
erklärt wurde, überwiegt in einer stark sauren Lösung die Konzentration von HInd jene von
Ind–, so dass die Lösung die Farbe von HInd annimmt. In alkalischer Lösung ist es
genau umgekehrt.
Im Umschlagsbereich sind die Konzentrationen von HInd und Ind– in etwa gleich groß,
so dass die Lösung eine Mischfarbe zeigt. Dies ist z. B. der Fall, wenn c(HInd) = c(Ind–).
Aus der Henderson-Hasselbalch-Gleichung folgt für diesen pH-Wert:
pH = pKS für c(HInd) = c(Ind–).
Entspricht also der pH-Wert der Lösung dem pKS-Wert der Indikatorsäure, so liegt die Mischfarbe des Indikators vor. Die Lösung zeigt jedoch auch dann noch eine Mischfarbe, wenn z. B. die Konzentration von HInd jene von Ind– nur leicht überwiegt. Erst wenn die Konzentration von HInd jene von Ind– um etwa das Zehnfache überwiegt (und somit c(Ind–) : c(HInd) = 1:10 = 0,1 gilt), zeigt die Lösung die reine Farbe von HInd. Wegen lg(0,1) = – 1 folgt dann aus der Henderson-Hasselbalch-Gleichung:
pH = pKS – 1 für c(Ind–) : c(HInd) = 1:10.
Überwiegt hingegen die Konzentration von Ind– jene von HInd um ungefähr das zehnfache, zeigt die Lösung die reine Farbe von Ind–. Aus der Henderson-Hasselbalch-Gleichung folgt nun:
pH = pKS + 1 für c(Ind–) : c(HInd) = 10:1.
Nun wird deutlich:
Der Umschlagsbereich eines Säure-Base-Indikators erstreckt sich in der Regel über einen Bereich von etwa 2 pH-Einheiten um den pKS-Wert der Indikatorsäure herum.
Die Umschlagsbereiche einiger gängiger Säure-Base-Indikatoren sind in einer Graphik auf der Seite "Säure-Base-Indikatoren" dargestellt. Man muss jedoch betonen, dass auch subjektive, physiologische Effekte bei der Beurteilung von Indikator-Umschlägen zu berücksichtigen sind. Beispielsweise ist der Umschlag von Farblos nach Rot (Phenolphthalein) früher zu erkennen als der von Farblos nach Gelb (p-Nitrophenol).
Weitere Texte zum Thema „Indikatoren“