 |
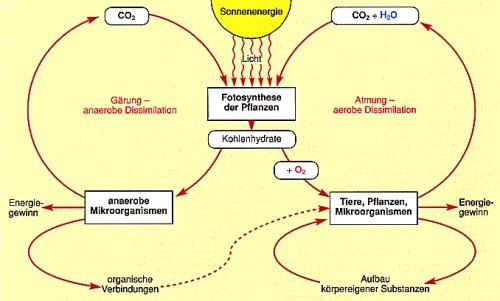
| Bild 1: Energieumwandlungen bei Aufbau und Abbau von Biomasse
(Quelle: Cornelsen) |
Woher die Energie für die enzymatischen Reaktionen stammt
Experimente:
Versuch: Hydrolyse von Phosphoroxid als ATP-Modell
Jeder Mensch fühlt sich subjektiv als unveränderlich. Dennoch unterliegt sein Körper
dem dynamischen Zustand ständiger Umwandlung und Erneuerung. Das alles beruht
auf interzellulären chemischen Reaktionen, die sehr viel Energie verbrauchen. Das gilt
auch, wenn man mechanische Arbeit leistet oder sogar, wenn man denkt. Deshalb
benötigen Schüler im Alter zwischen 15 und 18 Jahren täglich etwa 10700 kJoule.
Diese Energie nehmen sie mit den Nahrungsmitteln zu sich, die andere Organismen
mehr oder weniger freiwillig für sie bereitstellen. Hierbei ist etwa nicht die Wärme von
heißen Speisen gemeint. Die Energie ist in den Nährstoffen versteckt. Zum Beispiel
nehmen Sportler Dextroenergen (R) zu sich, wenn sie Energie
tanken wollen. Das ist letztlich nichts anderes als Traubenzucker oder Glucose.
 |
| Bild 1: Energieumwandlungen bei Aufbau und Abbau von Biomasse
(Quelle: Cornelsen) |
Der Ursprung der chemischen Energie in den Nahrungsmitteln
Die Glucose hat es in sich: Sie steht am Anfang der Energiespeicherung in
Nahrungsmitteln. Es beginnt bei den Pflanzen: Diese synthetisieren die Glucose aus
den beiden anorganischen Substanzen Wasser und Kohlenstoffdioxid.
6 CO2 + 12 H2O ———> C6H12O6 + 6 H2O + 6 O2 D H = 2900 kJoule/mol
Die Energie für diese endotherme Reduktion des Kohlenstoffdioxids beträgt etwa 2900
kJoule/mol Glucose. Wir nennen sie chemische Energie. Sie ist umgewandelte
Strahlungsenergie der Sonne. Empfangsantenne für die Strahlungsenergie ist der
grüne Blattfarbstoff, das Chlorophyll. Man bezeichnet die Reaktion deshalb auch als
Fotosynthese. Aus Glucose und Stickstoff-, Schwefel- und
Phosphorverbindungen (und vielen anderen) baut die Pflanze weitere für sie
lebensnotwendige Stoffe wie Proteine, Nucleinsäuren und Vitamine auf.
Mit der pflanzlichen Nahrung nehmen wir auch die in ihr steckende chemische Energie
auf. Diese wird beim Abbau der Nahrungsmittelmoleküle in den 100 Billionen (1014)
Zellen, die unseren Körper aufbauen, freigesetzt und dabei umgewandelt.
Energieäquivalente der wichtigsten Nahrungsbestandteile (Durchschnittswerte)
| Kohlenhydrate | 17,6 kJ/g |
| Fette | 39,7kJ/g |
| Proteine | 18,0 kJ/g |
Wenn wir uns über die unterschiedlichen Energiewerte von Kohlenhydraten und von Fetten wundern, müssen wir uns deren Molekülbau ansehen. Die typische durchschnittliche Bau-Einheit der Fette ist (H-C-H), die der Kohlenhydrate (H-C-OH). Letztere befinden sich in einem höheren Oxidationszustand, sind also energieärmer. (Ähnliches wie für die Kohlenhydrate gilt für die komplizierter zusammengesetzten Aminosäuren als Protein-Bausteine.)
Wie wird die chemische Energie der Nahrungsmittel umgewandelt?
Die meisten Nahrungsmittel wie die Fette, Proteine sowie höhere Kohlenhydrate
(Saccharose und Stärke) bestehen aus großen Molekülen, die zunächst in ihre
Bausteinmoleküle gespalten werden müssen. Bei der Verknüpfung der Bausteine
dieser Stoffe musste Energie aufgewendet werden. Deshalb wird bei der Spaltung
unter Hydrolyse Wärme frei. Entsprechend heiß wird es nach einem guten Essen
in unserem Darmtrakt.
Der größte Teil der in den Nahrungsmitteln enthaltenen chemischen Energie wird
jedoch erst beim oxidativen Endabbau zu Wasser und Kohlenstoffdioxid freigesetzt
("Verbrennung"). Anders als Wärme kann diese Energie zu endothermen Synthesen
körpereigener Moleküle und für andere vielfältige Körperfunktionen herangezogen
werden.
Die universelle Energiewährung der Zellen: ATP
Leider können die Enzyme mit der chemischen Energie, die in Stoffen wie Glucose
oder Fettsäuren steckt, bei Synthesereaktionen direkt nichts anfangen. Zuvor muss die
chemische Energie der Nahrungsmittel in Form von speziellen Verbindungen
umgewandelt und zwischengespeichert werden. Das ist sozusagen die allgemein
gültige "Energiewährung", die von allen Enzymen in allen Zellen und allen
Organismen genutzt werden kann.
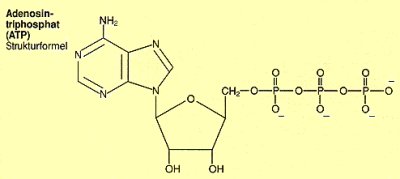 |
| Bild 2: Strukturformel von ATP
(Quelle: Cornelsen) |
Die wichtigste derartige universelle Verbindung ist Adenosintriphosphat, abgekürzt
ATP. In ihr sind drei Phosphorsäuremoleküle (abgek. P) untereinander linear
verknüpft. Man schreibt die Formel vom ATP deshalb auch so:
A-P~P~P
Die zwei ~-Bindungen zwischen den Phosphorsäureresten sind Säureanhydridbindungen. Das ATP-Molekül enthält dazu in dieser Phosphatreihe noch vier negative Ladungen. Damit sind die Bindungen sehr energiereich, was folglich auch für das ganze Molekül gilt. Man vergleicht das ATP-Molekül gern mit einer gespannten Feder. Was für Energien in den Anhydridbindungen stecken, kann man anhand der Hydrolyse des Säureanhydrids von Phosphorsäure, Phosphorpentoxid P4O10, demonstrieren (-> Versuch):
P4O10 + 6 H2O ———> 4 H3PO4
A-P~P + P ———> A-P~P~P + H2O /endotherm
Die Energie beträgt pro ~-Bindung etwa 50 kJoule/mol. Sie entstammt einer simultan ablaufenden Oxidation von Nahrungsmittelmolekülen oder einer anderen Energie freisetzenden Reaktion. Pro Molekül Glucose entstehen 38 Moleküle ATP. Wir sprechen hier von gekoppelten Reaktionen.
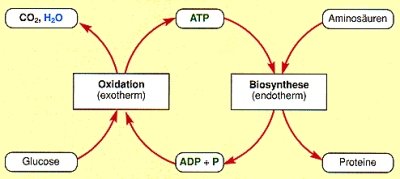 |
| Bild 3: Kopplung von Oxidation und Biosynthesen über ATP (schematisch)
(Quelle: Cornelsen) |
Die Knüpfung und Spaltung der Säureanhydrid-Bindungen im ATP sind leicht
reversibel. Wenn ATP zu ADP+P gespalten wird, wird die Energie frei.
A-P~P~P + H2O ———> A-P~P + P /exotherm
Es kann auch ein Pyrophosphat (P~P) abgespalten werden. Dann entsteht AMP, Adenosinmonophosphat.
A-P~P~P + H2O ———> A-P + P~P /exotherm
Der Energiegewinn ist etwa 10 % höher als bei der ADP-Bildung.
Kopplung von ATP-Stoffwechsel und biologischen Funktionen
Simultan mit der Hydrolyse einer ATP-Bindung kann eine andere chemische Bindung
geknüpft werden wie die Vollacetalbindung zwischen Zuckermolekülen, die
Peptidbindung zwischen Aminosäuren oder die Esterbindung zwischen Fettsäuren
und Glycerin. Dabei helfen Biokatalysatoren, die Enzyme. Sie erleichtern die
Reaktionen, weil sie die Aktivierungsenergie stark herabsetzen. Dadurch wird Energie
gespart, die biochemische Synthese ist deshalb besonders sparsam. Man sagt auch,
dass sie einen hohen Wirkungsgrad aufweist.
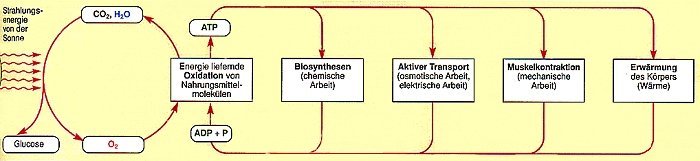 |
| Bild 4: Kopplung von ATP-Stoffwechsel und einigen biologischen Funktionen
(Quelle: Cornelsen) |
Im Körper laufen neben den genannten Synthesen weitere unzählige ATP-verbrauchende Prozesse ab. Auch diese werden allesamt enzymatisch unterstützt.
Beispiele sind:
ATP ist die am häufigsten synthetisierte organische
Verbindung der Erde
Aufschluss über die ständige biochemische Reaktionstätigkeit in unserem Körper gibt
die Tatsache, dass ATP die meist synthetisierte biochemische Substanz der Erde ist.
So werden allein beim oxidativen Abbau von einem Molekül Glucose 38 ATP-Moleküle
gebildet. Die Synthese von Glucose durch die Pflanzen "kostet" noch mehr, nämlich
54 ATP. Pro Tag stellt unser Körper eine Menge an ATP her, die seinem halben
Gewicht entspricht, und er spaltet es auch gleich wieder. Dabei enthält ein
Schülerkörper von durchschnittlich 70 kg Gewicht insgesamt nur etwa 150 g dieser
energiereichen Substanz! Besonders reich an ATP ist das Muskelgewebe. Es enthält
auf 100 g etwa 350-400 mg ATP.
Der biochemische Wirkungsgrad
Leider kann nicht die ganze chemische Energie, die im ATP steckt, genutzt werden.
Es gibt immer Wärmeverluste. Wenn man sich körperlich betätigt, wird einem warm.
Auch in der Biochemie arbeitet man mit dem technischen Begriff Wirkungsgrad
h. Unter h versteht man das Verhältnis von nutzbarer
Energie zu eingesetzter Gesamtenergie. Optimal ist ein Wert von 1 oder 100 %.
Normalerweise liegt er aber weit darunter.
Das soll am Beispiel der Oxidation der Glucose (der exothermen Umkehrung der
Fotosynthese-Reaktion) erläutert werden. Die bei der Verbrennung von einem Mol
Glucose insgesamt freigesetzte Energie beträgt etwa 2900 kJoule. Nur ein Teil davon
ist als wertvolle chemische Energie in der Form von ATP durch den Körper für eigene
Tätigkeiten direkt verwertbar. Der Anteil beträgt bei 38 ATP pro Molekül Glucose.
38 · 50 kJoule/mol = 1900 kJoule/mol
Das ist ein Anteil von 1900/2900 = 0,66 oder 66 %; das ist der Wirkungsgrad. Der Rest von 34 % besteht aus wertloser, für Biosynthesen oder Muskelkontraktionen nicht nutzbarer Wärme.
Wenn man zusätzlich bei Biosynthesen, an denen ATP beteiligt ist, einen Wirkungsgrad von 90 % annimmt, muss man zur Errechnung des Gesamtwirkungsgrades beide Wirkungsgrade multiplizieren; er beträgt daher
0,65 · 0,9 » 0,59 oder 59 %
Bedenkt man, dass die Synthese von Glucose durch die Pflanzen 54 ATP/mol verbraucht, so kann man auch hier einen Wirkungsgrad angeben:
38/54 = 71 %
Wenn der Körper ohne simultane Stoffwechselleistung Wärme durch Spaltung von ATP erzeugt, ist der Wirkungsgrad Null; aber das Lebewesen wird vor dem Erfrieren bewahrt. Man sieht hier, dass man den Wirkungsgrad biologischer Systeme nicht gar zu technisch sehen darf.
Dass der Wirkungsgrad unter 1 liegt, hat aber noch ganz andere Folgen: Die ständige
biochemische Tätigkeit in ihren Zellen ist der Grund dafür, dass Lebewesen zu ihrer
Existenz wesentlich mehr fremde Biomasse vernichten müssen, als sie selbst
aufbauen. Ein kleiner Singvogel muss bei seinem hohen Stoffwechselniveau täglich
sogar das Drei- bis Vierfache seines Körpergewichts an Pflanzensamen,
Regenwürmern oder Insekten verputzen.
Nur so können Organismen das werden und bleiben, was Lebewesen in der
unbelebten Natur sind: Inseln von hoher Ordnung und mit erstaunlicher Stabilität in
einer ansonsten chaotischen Umgebung, die der Nivellierung zustrebt. Lebewesen
sind also thermodynamisch gesehen Systeme, deren Zustand weit weg vom
Gleichgewicht liegt. Entfällt die ständige potentialerhaltende Energiezufuhr, so ist der
Organismus zum Sterben verurteilt. In der Biochemie bedeutet Gleichgewichtszustand
den Tod.
Der Wirkungsgrad biochemischer Vorgänge ist aber immer noch weitaus höher als bei den allermeisten von Menschen konstruierten Maschinen. Deshalb ist das Leben auch die erfolgreichste Form der Materie!
Wasser als Energiepuffer
Es taucht noch ein Problem auf: Was schützt unseren Körper vor lokaler Überhitzung, die
aufgrund der Freisetzung von Reaktionswärme eintritt? Große, für die Funktion des Körpers extrem
wichtige Moleküle wie Proteine oder Nukleinsäuren (DNA) sind sehr empfindlich gegenüber zu starker
Wärmezufuhr. Es gibt überhaupt nur einen engen, kühlen Temperaturbereich, in dem diese organischen
Moleküle stabil sind und ihre Funktionen ausüben können. Möglichkeiten zur Überhitzung gibt es
zunächst bei den exothermen Hydrolysereaktionen im Darmtrakt und in den Zellen. Noch stärker
exotherme Redoxreaktionen, aus denen der Körper die chemische Energie für die Lebensvorgänge
bezieht, laufen bevorzugt auf engem Raum wie in Leber, Muskel und Gehirn ab. Sie heizen diese
Organe auch bei gesunden Menschen auf weit über 40 °C auf.
Retter ist das Wasser, die vielfältigste
Grundlage unseres Lebens. Das ist glücklicherweise die in unserem Körper am häufigsten
vorkommende chemische Verbindung. Als Wärmepuffer adsorbiert Wasser die Wärme aufgrund
seiner hohen Wärmekapazität und transportiert sie über den Blutkreislauf ab. Seine hohe
Verdampfungswärme sorgt weiter dafür, dass die überschüssige Wärme mit der Verdunstung
von Schweiß abgegeben werden kann. Sie wird auch mit dem Wasserdampf der Atemluft oder
mit Urin und Fäkalien "entsorgt".
Weitere Texte zum Thema „Katalyse“