Herabsetzung der Aktivierungsenergie
Experimente:
Modellversuch zu Döbereiners Feuerzeug
Versuch: Verschiedene Wege zur Hydrolyse von Stärke
Katalysatoren setzen die Aktivierungsenergie einer chemischen Reaktion herab. Dafür
gibt es genügend Beispiele:
In Gegenwart des Platins reagieren Sauerstoff und Wasserstoff schon bei niedrigen Temperaturen ohne Zündfunken miteinander, ohne dass man es sehen kann (-> Versuch). Die Energie der beginnenden, noch nicht sichtbaren Oxidationsreaktionen bringt das Metall zum Glühen und entzündet dann das Gasgemisch.
Stärke ist ein sehr stabiles Polysaccharid, das aus Glucose-Bausteinen aufgebaut ist. Es handelt sich bei dem Makromolekül um eine "endotherme" Verbindung, das heißt, sie wurde unter Energieaufwand synthetisiert. Deshalb sollte sie unter Freisetzung dieser Syntheseenergie und Wasseraufnahme wieder in die Glucosemoleküle zerfallen. Selbst durch Kochen in Wasser gelingt es aber nicht, diese Reaktion rückgängig zu machen, weil die Aktivierungsenergie zu hoch ist. Fügt man jedoch etwas Säure hinzu, so setzt die Hydrolyse augenblicklich ein (-> Versuch). Säure ist also ein Katalysator. Genau genommen sind es die Protonen der Säure, die entsprechend wirksam sind. Man muss allerdings kochen. Nimmt man statt der Säure einen Biokatalysator, ein Enzym, so gelingt die Hydrolyse der Stärke bereits bei Zimmertemperatur.
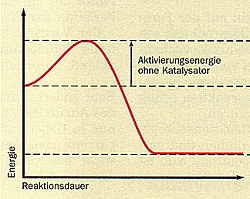
Die Herabsetzung der Aktivierungsenergie kann man sehr schön in einem
Reaktionsdiagramm (Bild) verdeutlichen. Hier wird die Energieänderung im Verlaufe
einer chemischen Reaktion dargestellt.
Man erkennt, dass man ausgehend von den Edukten zunächst den Betrag der
Aktivierungsenergie zuführen muss, um die Edukte in einen "aktivierten" Zustand zu
überführen, aus dem heraus sie reagieren können. Dann bilden sich die Produkte,
deren Energieinhalt um den Betrag der Reaktionsenergie niedriger ist. Die
Aktivierungsenergie wird dabei wieder frei.
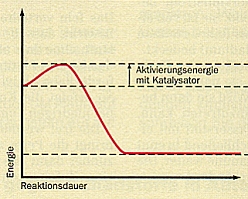
Mit einem Katalysator wird die Aktivierungsenergie verringert; das Maximum der Kurve
liegt dann nicht mehr so hoch. Der Trick ist, dass der Katalysator mit dem Edukt und oft
auch noch mit dem Produkt Zwischenverbindungen bildet, deren Bildung und Zerfall
insgesamt eine niedrigere Aktivierungsenergie benötigen als die unkatalysierte
Reaktion. Solche Zwischenverbindungen kann man übrigens
manchmal sehen.


Reaktionsdiagramme von Reaktionen ohne und mit Katalysator
(Quelle: Cornelsen)
Die Herabsetzung der Aktivierungsenergie macht die Reaktionen steuerbarer, also schonender, schafft weniger Nebenprodukte und spart Wärmemüll. Katalysen sind somit für die Umwelt von großer Bedeutung.
Weitere Texte zum Thema „Katalyse“