Redox-Katalysereaktionen an Elektroden sind die Grundlagen von
Brennstoffzellen
Experimente:
Versuch: Betrieb einer Brennstoffzelle
Versuch: Betrieb einer Brennstoffzelle mit Glucose

Brennstoffzelle
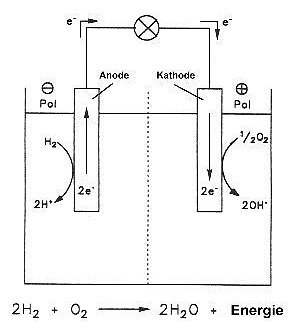
Eine Brennstoffzelle ist eine galvanische Zelle, bei der die chemische Energie, die
sonst bei Verbrennungsprozessen freigesetzt wird, zum größten Teil direkt in
elektrische Energie umgewandelt wird.
In der Brennstoffzelle wird unter Vermittlung von katalytisch wirkenden Elektroden
aus Metallen wie Platin oder Nickel der Prozess, der bei einer Verbrennung oder
Knallgasreaktion ungebremst abläuft, so fein gesteuert, dass Reaktionsenergie bei der
Verbrennung von Wasserstoff nicht als wertlose Wärme frei wird, sondern in
hochwertige elektrische Energie umgewandelt werden kann. Als Reaktionsprodukt
entsteht je nach Brennstoff nur Wasser, CO2 oder Stickstoff.
Die Verbrennungsreaktion zwischen Wasserstoff und Sauerstoff ist eine Redox-Reaktion
mit Elektronenübertragung, auch wenn es auf den ersten Blick nicht so
deutlich ist. Die Wasserstoffatome übertragen je ein Elektron auf Sauerstoffatome.
Dabei wird Energie frei, bestenfalls unter gleichmäßiger Verbrennung,
schlimmstenfalls wie bei der Knallgasexplosion.
Wenn man Elektronenabgabe und -aufnahme an getrennten Orten ablaufen lässt, fließt
dazwischen ein elektrischer Strom. Wasserstoff und Sauerstoff reagieren ohne
Flammenerscheinung und Explosion zu Wasser (-> Versuch).
Man spricht hier treffend von "Kaltem Feuer".
Die Elektroden von Brennstoffzellen sind Redox-Katalysatoren
Die elektronenübertragende Wirkung der Metalle als Redox-Katalysatoren beruht auf
folgendem Mechanismus. Zunächst adsorbieren sie die Moleküle von Brennstoff bzw.
Oxidationsmittel. Wasserstoff wird dabei vom Platin in einzelne Atome gespalten und
regelrecht aufgesogen. Dabei geben die Wasserstoffatome ihre Elektronen ab, werden
also oxidiert. Die Elektronen wandern durch das Metallgitter von Elektrode und
äußerem Leiter zum anderen Pol, wo Sauerstoff adsorbiert ist. Dieser nimmt aus dem
Metallgitter des Platins die Elektronen auf und wird reduziert. Elektroden, die nur
Redoxprozesse katalysieren und sich dabei stofflich nicht verändern, nennt man
Elektroden III. Art.
Statt Platin kann man auch andere Metalle aus der gleichen Ecke des PSE nehmen.
Es handelt sich bei allen um die bekannten "Hydrierkatalysatoren". Beispiele sind die
Platinmetalle und die Metalle der Eisengruppe. Mit Nickel hydriert man bei Fetthärtung
ungesättigte Fettsäuren. Eisen ist der Katalysator bei der Haber-Bosch-Synthese. In
der Brennstoffzelle sind die Eisengruppen-Metalle direkt nur an der Anode einsetzbar,
also als Oxidierkatalysatoren. An der Kathode bilden sie mit dem Sauerstoff zu leicht
Oxide. Das umgeht man, indem man zum Beispiel von vornherein Nickel/Nickeloxid-Elektroden
mit speziellem Gitteraufbau einsetzt.
Nickel ist vielleicht nicht so effektiv wie Platin, dafür aber billiger.
Es wird deutlich, dass eine Vergrößerung der Elektrodenoberfläche die Stromausbeute
erhöht. Zum Vergrößern der Oberfläche stellt man feinstverteilte Platinkristalle her.
Dazu fällt man Platinmetall reduktiv auf dem Trägermaterial aus. Ein Problem ist, dass
diese Kriställchen zusammenwachsen und die Oberfläche dadurch verkleinern.
Man kann auch feinstverteiltes Nickel sintern (Raney-Nickel). Diese
Nickelschaumelektroden sind relativ stabil.
Zur Information über die technische Realisierung der Gasdiffusions-Elektroden bei den Brennstoffzellen haben wir eine Folie vorbereitet.
Warum die Leistung der Brennstoffzellen so konstant ist
Da an den Elektronenübertragungsreaktionen nur Nichtmetalle bzw. deren ungeladene
Verbindungen beteiligt sind, sind die Vorgänge an den Elektrodenoberflächen
ausschließlich diffusionsbestimmt. Es treten deshalb auch bei stärkerem Stromfluss
keine Polarisationen und Grenzschichten auf, die von ionischen Edukten nicht
durchwandert werden können. Das führt dazu, dass die energieliefernden Prozesse
bei einer Brennstoffzelle über einen weiten Bereich (anders als bei den klassischen
galvanischen Elementen wie zum Beispiel dem Bleiakku) unabhängig von der
Stromentnahme sind. Erst wenn die Leistungsanforderungen zu hoch werden,
gelangen auch durch Diffusion nicht ausreichend Edukte an die Oberfläche, die
Spannung und Leistung der Brennstoffzelle brechen ein.
Zur Vertiefung des Themas "Brennstoffzellen" haben wir eine eigene große Webseitensammlung erstellt.
Weitere Texte zum Thema „Katalyse“