Oxidation von Aceton- oder Methanoldampf an Metall
Experimente:
Versuch: Oxidation von Alkoholen und Ketonen an Kupferdraht
Versuch: Oszillationen bei der Oxidation von Methanol mit Platinnetz
Problematisch ist die Oxidation von Stoffen wie den Alkoholen, Aldehyden oder
Ketonen, vor allem wenn es um die Synthesen von Zwischenstufen geht. Denn die
organischen Lösemittel lassen sich - nach Anzünden als Aktivierung - meistens nur
nach dem "Alles oder Nichts"-Prinzip oxidieren. Sie verbrennen deshalb meistens nur
zu CO2 und H2O.
Mit heterogenen Katalysatoren kann man organische Stoffe gezielter umsetzen,
oftmals sogar die Reaktionen in die gewünschten Richtungen lenken.
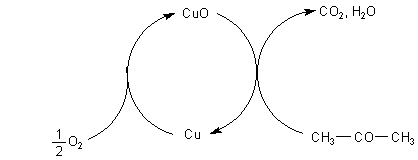
1. Oxidation von Aceton an Kupferdraht
Kupfer überträgt Oxidationsäquivalente auf Reduktionsmittel wie Aceton, indem es
zuerst selbst zu Kupferoxid oxidiert wird und dann seinen Sauerstoff auf das Aceton
überträgt.

Dabei spielen Oberflächenprozesse eine Rolle, deren Verlauf man mit einer Kupferspirale sichtbar machen kann (-> Versuch). Besonders fällt das Changieren der Farbe der Oberfläche auf, das von einem periodischen Aufglühen der Drahtspirale begleitet wird. Das Belegen mit Sauerstoff färbt die Oberfläche dunkel (Bildung von Cu-Oxiden). Die anschließende Reaktion mit Aceton lässt die Spirale wegen der Abgabe des Sauerstoffs blank werden und aufgrund des Freisetzens der Oxidationsenergie von Aceton hell aufglühen.
2 Oxidation durch Platin
Gleiches erkennt man auch bei der spektakulären Oxidation von Methanoldampf
in Anwesenheit von Platin. Dabei entsteht Formaldehyd (-> Versuch).
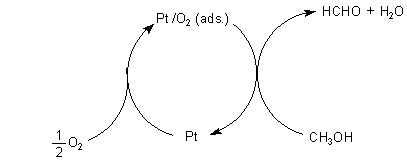
Hier findet keine Primäroxidation des Schwermetalls statt wie beim Kupfer, sondern
nur eine simultane Anlagerung der beiden Edukte Methanol und Sauerstoff. Das
geschieht nach Gesetzen des kristallinen Aufbaus des kubischen Platingitters. Platin
ist mikrokristallin aufgebaut. Es liegen also zufallsbedingt viele Kristalle
nebeneinander vor. Bestimmte Flächen dieser Kristalle werden nur vom Sauerstoff,
die anderen nur vom Methanol besetzt. Durch Überlappen der "Molekülorbitale" des
Metalls (seine so genannten Leitungsbänder) und der Molekülorbitale der Edukte wird
die Redox-Reaktion vorbereitet. Eingeleitet wird sie durch Kontakt der so aktivierten
Edukt-Moleküle an den Grenzbereichen der Kristallflächen.
Wie beim Döbereiner Feuerzeug beginnt die Reaktion mit dem Aufglühen des
Metallnetzes. Bei vollständiger Reaktion entzündet die gesamte Reaktionsmischung.
Damit verschwindet die Glut des Metallnetzes. Denn nun fehlen die abreagierten
Edukte der Reaktion. Diese müssen erst langsam wieder in das Reaktionsgefäß
einwandern, sich dann auf der Oberfläche ihre Plätze suchen und dann die Reaktion
erneut einleiten. Damit wird wieder Reaktionswärme frei, die das Platinmetall zum
Glühen bringt. Diese Glut zündet erneut das im Reaktionsgefäß gebildete
Reaktionsgemisch aus Methanoldampf und Sauerstoff.
Insgesamt resultiert daraus eine bemerkenswert lang anhaltende, beeindruckende
Oszillation, die allerdings etwas experimentelles Geschick und chemisches
Fingerspitzengefühl erfordert.
 |
| (Foto: Daggi)
Hierzu gibt es einen Film (9,1 MB) Klicke hier |
Weitere Texte zum Thema „Katalyse“