Katalyse-Reaktionen sind Kreisprozesse
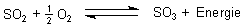
Betrachten wir einmal die folgende Reaktion genauer.

Diese Reaktion ist ein chemisches Gleichgewicht, das sehr ungünstig auf der Seite der Edukte liegt. Grund: Die Aktivierungsenergie ist größer als die Reaktionsenergie, so dass das SO3-Molekül wieder zerfällt. Mit einem Katalysator senkt man die Aktivierungsenergie und treibt damit die Bildung von SO3 voran.
Die Teilnahme von Katalysatoren beschreibt man gern, indem man sie über den Reaktionspfeil vermerkt.

Um den genauen Mechanismus der Katalysereaktion zu beschreiben, formuliert man die Reaktion gern als Zweischrittmechanismus:
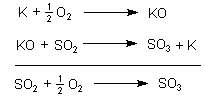
Die Addition der beiden Gleichungen führt zur gleichen Bruttogleichung wie oben. Der Katalysator entfällt rechnerisch.
Einsichtiger ist der Ablauf der katalysierten Reaktion, wenn wir sie als einen Kreisprozess formulieren.
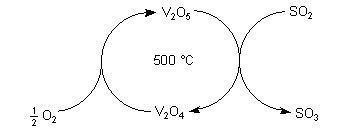
Ein Katalysator ist ein Stoff, der an einem Reaktionskreisprozess teilnimmt. Nach dessen Durchlaufen liegt er wieder unverändert und zu neuer Reaktion bereit vor.
Es können natürlich auch mehrere Kreisprozesse ineinandergreifen. Das ist der Fall bei der bodennahen Ozonbildung. Dabei ist die Oxidation von Kohlenstoffmonoxid und anderen Kohlenstoffverbindungen über zwei Katalysekreisprozesse mit der Ozonsynthese gekoppelt. Gleiches gilt auch für die Abläufe bei der Zerstörung von stratosphärischem Ozon.
Aber auch an die komplexen biochemischen Reaktionszyklen ist hier zu denken.
Weitere Texte zum Thema „Katalyse“