
Schwefelsäure zersetzt Kohlenhydrate
Experimenteliste zu den Kohlenhydraten
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Die Tendenz von Schwefelsäure, Wasser an
sich zu reißen, geht so weit, dass sie sogar aus organischen Molekülen Wasser
abspaltet. Das kann man bekanntlich besonders gut an den Kohlenhydraten zeigen,
die dabei verkohlen. Formal gilt:
C6H12O6 + 6 H2SO4 ———> 6 C + 6 H2SO4 · H2O / exotherm
Einen besonders schönen Reaktionseffekt erzielst du mit Saccharose (Rüben- oder Rohrzucker).
|
Versuch 1: Zersetzung von Saccharose durch Schwefelsäure (Zuckerkohle-Versuch)
|
Dass hierbei deutlich Schwefeldioxid zu riechen ist, zeigt, dass bei der Saccharosezersetzung auch komplizierte Redox-Vorgänge ablaufen. Lies dazu auch unsere Hintergrundinformationen.

Bild 1 (Foto: Blume)
Die Wirkung von konzentrierter Schwefelsäure auf Kohlenhydrate kannst du auch in einem anderen
Versuch zeigen.
|
Versuch 2: Wirkung von Schwefelsäure auf Leinen
b) Tropfe auf ein größeres Leinenstück etwas verdünnte Schwefelsäure (c = 1 mol/L; Xi) und lege das Stück beiseite. Prüfe die betropfte Stelle nach einer Woche (Bild). |

Bild 2 (Foto: Blume)
Wegen dieser Fähigkeit, organisches Material zu zersetzen, ist die Schwefelsäure so aggressiv und
gefährlich. Dafür gibt es sogar Beispiele aus der Geschichte.
Technische Anwendungen der Schwefelsäure-Hygroskopie
Die große Affinität zu Wasser ist aber auch Grundlage einiger technischer Verfahren:
Taucht man z. B. Papier, das aus Cellulose besteht, kurzfristig
in die Säure, so verkohlt es nicht, sondern wird in Pergamentpapier umgewandelt.
|
Versuch 3: Herstellung von Pergamentpapier
|
Wir lernen daraus, dass Pergamentpapier aus teilweise zerstörter Cellulose besteht. Deshalb gehört es auch nicht ins Altpapier.
Aber auch bei anderen chemischen Verfahren schätzt man die aggressive Hygroskopie der Schwefelsäure. Du kennst vielleicht die Veresterungsreaktionen, bei denen Schwefelsäure als Katalysator wirkt. Ein Beispiel:
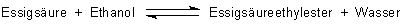
Genau genommen sind es ihre Protonen, die katalytisch wirken. Deshalb kann man hier auch jede beliebige Säure oder sogar saure Kationenaustauscher verwenden. Schwefelsäure absorbiert aber zugleich das Nebenprodukt Wasser und verschiebt damit das Gleichgewicht der Reaktion in Richtung auf Esterbildung.
Weitere Texte zum Thema „Kohlenhydrate“