 |
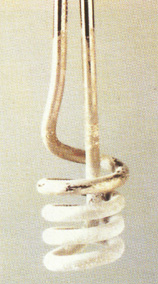
| Bild 1: Ablagerung von Kesselstein
(Quelle: Cornelsen) |
Weitere Anwendungen von Komplexen
Experimente:
Versuch: Bestimmung der Gesamtwasserhärte von Leitungswasser
Versuch: Wasserenthärtung mit EDTA
Versuch: Auflösen von Silberbromid durch Komplexbildung
Versuch: Darstellung von Berliner Blau
Versuch: Färben mit Berliner Blau
Versuch: Beizenfärbung mit Alizarin
Wasserhärte und Waschmittel
Die Härte des Wassers ergibt sich aus der Konzentration der gelösten Calcium- und
Magnesium-Ionen, d. h. je härter das Wasser ist, desto mehr dieser Ionen beinhaltet es. Dabei gilt
0,18 mmol/l Erdalkali-Ionen = 1 °dH (Deutscher Härtegrad).
Zur Bestimmung der Gesamthärte verwendet man das Verfahren der
komplexometrischen Titration.
Zum Thema Wasserhärte gibt es eine eigene Webseite.
Hartes Wasser vermindert die Waschwirkung von Seifen und Waschmitteln, da die Calcium- und
Magnesium-Ionen mit diesen schwerlösliche Salze (Kalkseifen) bilden.
Durch Erhitzen von hartem Wasser fallen Calcium- und Magnesiumcarbonat aus, die sich als
"Kesselstein" an Waschmaschinenrohren, Wasserhähnen etc. ablagern.
 |
| Bild 1: Ablagerung von Kesselstein
(Quelle: Cornelsen) |
Aus diesem Grund wird vielen Waschmitteln Wasserenthärter zugegeben. Dies sind Stoffe, die
mit den Metall-Ionen stabile wasserlösliche Chelatkomplexe bilden. Die Ionen werden maskiert.
(-> Versuch).
Ein guter Komplexbildner ist z. B. das Pentanatriumtriphosphat
(Na5P3O10). Da in der Kläranlage die gelösten Calciumkomplexe
zum Teil zerfallen, ist solch ein phosphathaltiger Wasserenthärter ökologisch bedenklich.
Phosphate führen bei stehenden oder langsam fließenden Gewässern stark zur Überdüngung
(Eutrophierung).
Deshalb wird immer häufiger Zeolith A zur Wasserenthärtung
eingesetzt. Zeolithe sind kristalline, wasserhaltige Aluminiumsilicate mit einer kompliziert
aufgebauten Gerüststruktur. Sie enthalten in ihrem Zentrum Alkali- oder Erdalkali-Ionen.
Beim Zeolith A (Na12[(AlO2)12(SiO2)12] · 27 H2O), auch Sasil genannt, lassen sich die Natrium-Ionen relativ leicht durch Calcium-Ionen ersetzen. Auch hierzu gibt es eine spezielle Webseite.
Fotografischer Prozess
Mit Thiosulfat S2O32- lassen sich
Silber-Ionen komplexieren. Das schwerlösliche Silberbromid reagiert bei Zugabe von Thiosulfat-Ionen
zu dem leichtlöslichen, stabilen Dithiosulfatoargentat(I)-Komplex und löst sich dabei auf
(-> Versuch).
AgBr + 2 S2O32-
![]() [Ag(S2O3)2]3-
+ Br-
[Ag(S2O3)2]3-
+ Br-
Dieser Vorgang findet beim Fixieren nach dem fotografischen Entwicklungsprozess statt. Dabei wird das unverändert gebliebene Silberbromid aus der lichtempfindlichen Schicht des Films herausgelöst, damit der Film ans Licht gebracht werden kann.
Farbstoffe und Färben
Aufgrund ihrer Farbigkeit gibt es auf der Basis von Metallkomplexen viele Farbstoffe.
Cyanoferrat-Farbpigmente sind zum Beispiel extrem farbstark und finden vielseitigen Nutzen
als Druckfarben, Autolacke, Buntpapiere oder Tinten. Ein historisch bekannter Komplexfarbstoff
ist das Berliner Blau Fe4[Fe(CN)6]3
(-> Versuch).
 |
| Bild 2: Berliner Blau |
| (Foto: Sandra) |
Er wurde früher u. a. auch verwendet, um die preußischen Uniformen blau zu färben
(-> Versuch).
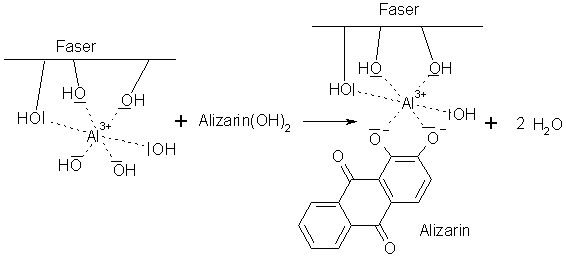
Ein anderes spezielles Färbeverfahren unter Anwendung von Komplexbildungsreaktionen ist die Beizenfärbung (-> Versuch). Hier wird ein ansonsten schwach bindender Farbstoff mit Hilfe von Metall(III)-Salzen auf der Faser verankert. Dazu tränkt man die zu färbenden Textilien vorher mit Metallacetaten. Unter Einwirkung von heißem Wasserdampf bilden sich dann durch Hydrolyse schwerlösliche Metallhydroxide.
Me3+ + 3 H2O
![]() Me(OH)3 + 3 H+
Me(OH)3 + 3 H+
Diese schlagen sich dann in feinster Form in der Faser nieder. Hierbei bilden sich schon
komplexartige Bindungen aus. Nach dieser Beize kocht man den Stoff in einem wässrigen Färbebad,
in dem der Farbstoff gelöst wurde.
Polare Gruppen der Faser (wie -NH2 oder -OH) sowie der Farbstoff bilden
dann über das Metall(III)-Ion wasserunlösliche Komplexverbindungen, die als
Farblacke bezeichnet werden.
Dieser Vorgang wird vor allem bei der Färbung von Wolle oder Leinen verwendet. Ein häufig
verwendeter Farbstoff hierfür ist das Alizarin, das aus der Krappwurzel gewonnen wird.
Dies ist ein o-Diphenol des Anthrachinons. Es bildet mit dreiwertigen Metall-Ionen (Al3+,
Fe3+ und Cr3+) rote Chelate.
Man kann unterschiedliche Farbtönungen erhalten, wenn verschiedene Metallsalze für die Beize benutzt werden. Mit Alaun (ein Aluminium-Doppelsalz) erhält man dann z. B. Karminrot, Chromlack ist violett und Eisenlack lilabraun.
 |
| Bild 3: Färbeergebnisse mit Alizarin bei verschiedenen
Komplexbildnern
(Foto: Daggi) |
Weitere Texte zum Thema „Komplexverbindungen“