 |
 |
| Bild 1: Blut enthält Hämoglobin
(Foto: Daggi) |
Bild 2: Blätter enthalten Chlorophyll
(Foto: Blume) |
 |
 |
| Bild 1: Blut enthält Hämoglobin
(Foto: Daggi) |
Bild 2: Blätter enthalten Chlorophyll
(Foto: Blume) |
Komplexe in der Biologie
Wie du vielleicht weißt, benötigen alle Lebewesen zu ihrer Lebenserhaltung viele
Mineralstoffe und Spurenelemente wie
z. B. Eisen, Zink, Kupfer, Mangan, Vanadium oder Zinn. Sie werden dem Körper durch die tägliche
Nahrung zugefügt. Aber wozu brauchen wir all diese Elemente?
Viele dieser Metalle fungieren als Zentralatome von Komplexen, die Bestandteile wichtiger
Enzyme oder Hormone sind.
1 Hämoglobin
Von großer Bedeutung ist u. a. auch die ausreichende Zufuhr von Eisen. Denn es ist für
viele Funktionen des Körpers lebenswichtig. Bei Eisenmangel fühlen wir uns matt und schlapp,
wirken blass und unkonzentriert. Wie kommt das?
Eine bedeutende Eisenverbindung in unserem Blutkreislauf ist das Hämoglobin.
Es ist nicht nur verantwortlich für die rote Farbe unseres Blutes, sondern dient
dem Sauerstofftransport.
Das Hämoglobin ist auf der Basis eines Eisen(II)-Komplexes aufgebaut. Dieses Großmolekül besteht
aus dem Protein Globin und dem Farbstoff Häm.
Es besitzt vier Proteine als Untereinheiten, die jeweils eine Häm-Scheibe umschließen.
Bei der Häm-Scheibe wirkt ein Eisen(II)-Ion als Zentralteilchen, um das ein ebenes Porphyrin-Gerüst als Chelat-Ligand mit vier Bindungsstellen angelegt ist. Durch die fünfte Bindungsstelle wird das Eisen-Ion über die Aminosäure Histidin mit dem Protein verbunden.
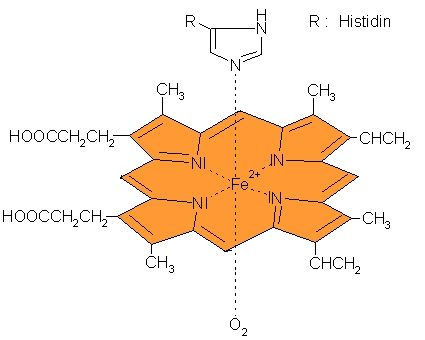 |
| Aufbau der Häm-Scheibe |
An der freien, sechsten Bindungsstelle des oktaedrischen Eisenkomplexes, kann sich nun ein
Sauerstoffmolekül anlagern. Durch den Blutkreislauf transportiert das Hämoglobin dann den
Sauerstoff aus der Lunge in die sauerstoffärmere Umgebung der Gewebe. Die Aufnahme und Abgabe
des Sauerstoffs ist dabei vom Partialdruck des Sauerstoffs aus der Atemluft abhängig:
O2 + Hb
![]() HbO2
HbO2
Auch das Sauerstoffmolekül fungiert hier als Ligand. Es ersetzt das ansonsten an dieser Stelle
gebundene Wassermolekül. Bemerkenswert ist, dass viele Blutgifte hier angreifen. So bildet auch das
Kohlenstoffmonoxid CO mit Hämoglobin einen Komplex, der 325 Mal stabiler ist als der mit Sauerstoff,
so dass es den Sauerstoff verdrängt oder seine Aufnahme verhindert. Ähnlich wirken auch Chlor und Stickoxide.
Allerdings tritt hierzu noch Oxidation des Eisen(II) zu Eisen(III), was mit Sauerstoff aufgrund der
Elektronenanordnung im Komplex nicht der Fall ist.
Das CO verdrängt man wieder, indem man Vergiftete unter ein Sauerstoffzelt oder in eine Überdruckkammer mit normaler Luft legt,
sie also einer hohen Konzentration von Sauerstoff aussetzt.
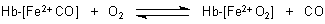
Dies ist ein typisches Beispiel für eine Gleichgewichtsverschiebung nach dem Le Chatelierschen Prinzip.
2 Myoglobin
In den Muskeln befindet sich das mit dem Hämoglobin verwandte, ebenfalls rote Myoglobin.
Es besteht nur aus einer Eisen(II)-porphinprotein-Einheit. In ihm wird das Sauerstoffmolekül gespeichert,
wo es nach Bedarf zur Energiegewinnung etwa durch Oxidation von Glucose wieder freigegeben
werden kann.
3 Cobalamin (Vitamin B12)
Ein anderes biologisch wichtiges Molekül, das auf der Basis eines Metallkomplexes aufgebaut ist, ist das Vitamin
B12. Es gehört zu den am kompliziertesten aufgebauten Naturstoffen, die man kennt.
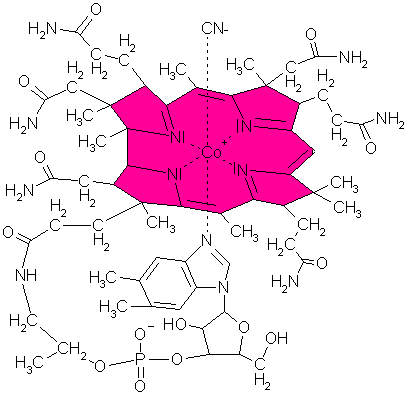 |
| Das Vitamin B12-Molekül |
Ähnlich wie beim Häm-Farbstoff liegt ein oktaedrisch koordinierter Chelatkomplex vor. Stickstoff-Ligand ist hier das
planare Corrinsystem. Ein Cobalt-Ion (Oxidationszahl +III) dient als Zentralteilchen. Man nennt das Vitamin B12 aus diesem
Grund auch Cobalamin. Vitamin B12 kommt vor allem als Cyanokomplex vor (siehe Strukturformel oben). Deshalb ist die übliche
Darreichungsform Cyanocobalamin.
Wässrige Lösungen von Vitamin B12 sind wie die der meisten Cobaltsalze pinkrot gefärbt.

Bild 3: Vitamin B12 (Cyanocobalamin; c = 1 mg/ml)
Als Farbvergleich dient ein typisches Cobaltmineral (Cobaltcalcit)
(Foto: Blume)
Wenn man die Lösung eindunsten lässt, erhält man die Kristalle des Vitamins.
Klick mich an!
Bild 4: Cyanocobalamin. Die B12-Kristalle erkennt man als feine rote Bündel. Die Oktaeder sind Protein-Kristalle.
(Foto: Blume)
Mit dem Cobalt haben wir ein typisches Spurenelement vor uns: Seine Verbindungen sind in größeren Mengen so giftig, dass man sie
bekanntlich aus dem Chemieunterricht verbannt hat. In geringen Spuren ist es aber unbedingt lebensnotwendig. Denn das Vitamin B12
wirkt bei der Synthese verzweigter Aminosäuren mit und ist unter anderem bei der Reifung der roten Blutkörperchen unentbehrlich. Da
es vom menschlichen und tierischen Organismus nicht selber hergestellt werden kann, ist eine ausreichende Versorgung durch die Nahrung
sehr wichtig. Bei Mangel tritt die so genannte perniziöse Anämie („bösartige Blutarmut“) auf.
4 Chlorophyll
Betrachten wir nun noch eine bedeutsame Komplexverbindung, die in der Pflanzenwelt auftritt.
Für das Grün der Blätter, Nadeln und Gräser ist der grüne Blattfarbstoff
Chlorophyll (griech. chloros: grün, phyllon: Blatt) verantwortlich.
Es handelt sich um einen Magnesiumkomplex mit einem Magnesium-Ion als Zentralteilchen und einem Porphyrin-Gerüst
als vierzähnigen Liganden.
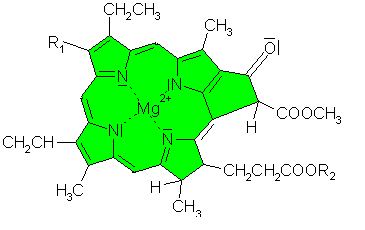 |
| Struktur der Chlorophylle a und b |
Es gibt mehrere verschiedene Chlorophyll-Pigmente. Die beiden häufigsten sind die Chlorophylle
a und b. Von ersterem gibt es in der Pflanze mehr als vom zweiten.
Sie unterscheiden sich lediglich in einem Substituenten. Während Chlorophyll a am Rest R1 eine Methylgruppe (-CH3) besitzt, hat das Chlorophyll b an dieser Stelle eine Aldehydgruppe (-CHO). Das hat Folgen für die Farbe: Chlorophyll a ist blaugrün, Chlorophyll b gelbgrün. Bei dem Rest R2 handelt es sich um einen langkettigen unpolaren Rest.
Als Farbstoffe absorbieren die Chlorophylle Licht und spielen deshalb eine große Rolle bei der Fotosynthese.
Weitere Texte zum Thema „Komplexverbindungen“