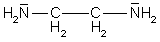
Chelatkomplexe
Experimente:
Versuch: Kupfer-Glycin-Komplex
Bei den Chelatkomplexen sind einzelne Liganden mit dem Zentralteilchen an zwei oder mehreren Stellen verbunden. Auch sie richten sich in symmetrischer Form aus.
Häufig sind es Komplexe mit zweizähnigen Liganden, wie das Ethylendiamin, kurz en:
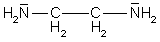
So legen sich zum Beispiel drei en-Moleküle oktaedrisch um ein Nickel(II)-Ion und bilden den Tris(ethylendiamin)nickel(II)-Komplex [Ni(en)3]2+:
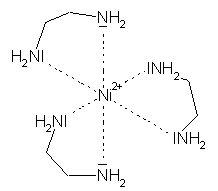
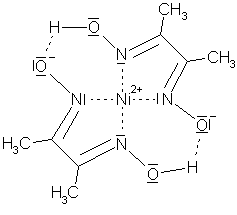
Ein anderes Beispiel ist das Dimethylglyoxim, kurz H2dmg:
Zwei solcher Liganden bilden mit einem Nickel(II)-Ion, jeweils an den beiden Stickstoffatomen gebunden, einen quadratisch-planaren Komplex, das Bis(dimethylglyoximato)nickel(II) [Ni(hdmg)2]2+.
Es gibt aber auch Liganden mit sechs Bindungsstellen, dessen Komplexe besonders stabil sind. Besonders effektiv ist die Ethylendiamintetraessigsäure, kurz edta.
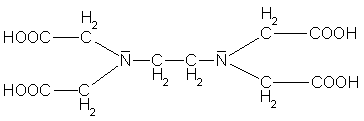
Ein edta-Molekül bildet besonders mit zweiwertigen Metall-Ionen im Komplex [Ca(edta)]2- eine oktaedrische Struktur.
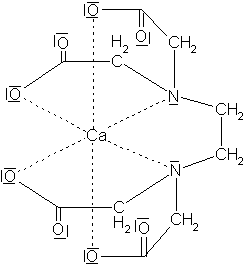
Der Calcium-edta-Komplex
Gute Chelatliganden sind auch die Aminosäuren. Das gilt zum Beispiel für die einfachste Aminosäure, das Glycin.
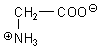
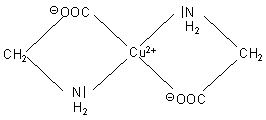
Zwei Glycinmoleküle bilden mit einem Kupfer(II)-Ion einen tiefblauen Komplex (-> Versuch).
2 Gly + Cu2+
![]() [Cu(gly)2] + 2 H+
[Cu(gly)2] + 2 H+
Dieser hat die folgende Struktur.
Farbige Chelate spielen in der Analytik eine wichtige Rolle, vor allem bei der Komplexometrie. Hiermit ermittelt man die Konzentrationen von Metall-Ionen durch Titration. Beispiele: Eriochromschwarz T bei der Wasserhärtebestimmung sowie Schwermetallbestimmung mit Murexid.
Die Bildung von farbigen Chelaten ist auch Grundlage zur Fixierung von Farbstoffmolekülen auf den Fasern (Beizenfärbung).
Weitere Texte zum Thema „Komplexverbindungen“