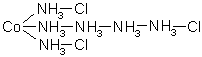
Historische Entwicklung der Komplexchemie
Komplexverbindungen wurden schon im Altertum in Form von Farblacken
oder Naturstoffen (wie z. B. Häm-Derivate aus Tierblut) verwendet.
Die erste wissenschaftlich dokumentierte Komplexbildung entstand 1597
durch den Arzt Andreas Labavius. Bei der Einwirkung einer Lösung aus Calciumhydroxid und
Ammoniumchlorid auf Bronze entstand eine Blaufärbung. Es handelte sich dabei um die
Komplexverbindung Tetraamminkupfer(II) [Cu(NH3)4]2+. Labavius
isolierte diese Substanz allerdings damals nicht.
1704 entdeckten die beiden Alchemisten Diesbach und Dippel
erstmals durch einen Zufall das Berliner Blau Fe4[Fe(CN)6]3
und isolierten es. Es wurde daraufhin als Farbstoff für
Textilien verwendet.
Im Jahre 1798 entdeckte ein gewisser Citoyen Tassaert einen
orangegelben Stoff beim Stehenlassen einer ammoniakalischen Cobaltchlorid-Lösung. Er hatte allerdings
keine Erklärung für die Bindungsverhältnisse dieses neu entstandenen Produkts. So stammte es doch
aus zwei völlig abgesättigten Verbindungen. Man formulierte es damals als eine Additionsverbindung:
CoCl3 · 6 NH3
Es wurde später als Cobaltchlorid-Ammonikat benannt.
1858 versuchte man diese Verbindungen nach Kekule's
"Strukturtheorie" zu beschreiben:
Jedes Element besitzt eine bestimmte Wertigkeit, die durch einen Bindestrich dargestellt wird,
der gleichzeitig die Atome miteinander verknüpft.
Nach Blomstrand und Jorgensen schrieb man diese Verbindung dann in folgender
Kettenstruktur:
Zu Beginn des 19. Jahrhunderts wurden eine ganze Reihe von Komplexverbindungen
synthetisiert, die meist nach ihren Entdeckern benannt wurden.
Erst 1893 gelang der entscheidende Durchbruch in der Geschichte der Komplexchemie.
Ein junger Chemiker namens Alfred Werner begründete, praktisch über Nacht, die
"Koordinationslehre" und fand damit endlich eine befriedigende Erklärung für den räumlichen
Aufbau dieses zuvor unverstandenen Verbindungstyps.
Werner unterschied bei diesen Verbindungen zwischen zwei verschiedenen "Sphären". In
der inneren "Sphäre" sind demzufolge eine bestimmte Anzahl von Atomen direkt an einem
Zentralteilchen gebunden, d. h. das Ion besitzt neben einer charakteristischen Ladung
auch eine Koordinationszahl, die nicht mit der Ladungszahl übereinstimmte.
Die äußere "Sphäre" beinhaltete (in Wasser frei bewegliche) Ionen, deren gesamte Ladung der
der "inneren Sphäre" entsprach.
Werner entwickelte für das zuvor erwähnte Ammonikat CoCl3 · 6 NH3
die Formel
[Co(NH3)6]Cl3
Nachträglich wurde diese Theorie von ihm und seiner Arbeitsgruppe durch 8000 neu hergestellte Substanzen bestätigt. Werner erhielt 1913 für seine Arbeiten den Nobelpreis.
Weitere Texte zum Thema „Komplexverbindungen“