 |
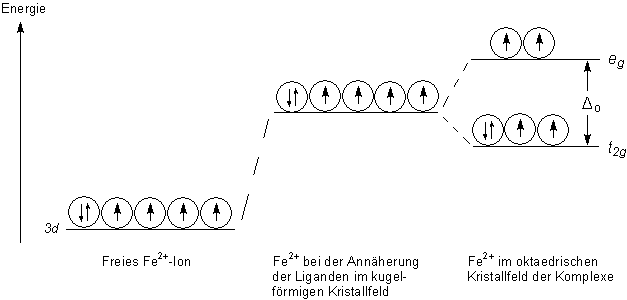
| Bild 2: Energieschema der 3d-Orbitale des Eisen(II)-Ions nach der Kristallfeldtheorie |
Für Experten: Moderne Theorien der Komplexbildung
Wie alle Modelle hat auch das Valence Bond-Modell (VB-Modell) von Pauling seine
Grenzen. Beispielsweise kann es nicht das Auffüllen äußerer Schalen eines
Zentralteilchens unter Auslassung seiner inneren d-Schalen erklären.
Dazu war es notwendig, Molekülorbital(MO)-Theorien auf die Beschreibung der
Komplexbildung anzuwenden. Daraus entstanden zunächst die Kristallfeldtheorie
und dann ihre Erweiterung, die Ligandenfeldtheorie.
Sie basieren beide auf der Ungleichverteilung der Elektronen um das
Zentralteilchen. Diese bilden die fünf verschieden geformten d-Orbitale.
Man kann die fünf d-Orbitale des Zentralteilchens in ein dreidimensionales
Koordinatensystem zeichnen. Man erkennt zwei Gruppen:
Es gibt zwei d-Orbitale, die ihre größte Elektronendichte in Richtung der x,y,z-Achsen haben.
Man bezeichnet sie als dg-Orbitale. Man nennt sie nach spektroskopischen
Daten auch eg-Orbitale.
Die restlichen drei d-Orbitale haben ihre größte Elektronendichte zwischen den
Achsen. Sie heißen de-Orbitale oder t2g-Orbitale.
1 Kristallfeldtheorie
Im Mittelpunkt der Betrachtung steht das Zentralteilchen. Es ist von einem elektrostatischen Feld,
dem "Kristallfeld", umgeben. Bei der Annäherung eines Liganden, der negativ geladen ist oder
negativ polarisiert ist, kommt es zunächst zu einer Abstoßung, d.
h., die potentielle Energie steigt an. Wegen der Form der d-Orbitale des
Zentralteilchens ("Elektronenlücken") hängt die Abstoßung von der Richtung ab,
aus der die Liganden kommen. Es gibt Ladungshäufungen und Ladungslücken. Der
Ligand wird beim Einklinken zur Verminderung der potentiellen Energie in eine
Lücke gedrängt.
Wir wollen das etwas genauer am Beispiel der oktaedrischen Komplexe von Eisen(II) erläutern.
 |
| Bild 2: Energieschema der 3d-Orbitale des Eisen(II)-Ions nach der Kristallfeldtheorie |
Das Bild zeigt das Energieschema der 3d-Orbitale des Zentralteilchens
Fe2+.
Im freien Zentralteilchen (rechts) sind die d-Orbitale fünffach entartet, haben also alle
gleiche Energie (links). Wenn sich die sechs Liganden nähern, steigt aufgrund der
Abstoßung deren Energie (Mitte). Nach Einklinken der Liganden spalten die d-Orbitale
in zwei Gruppen auf (rechts). Die dg-Gruppe hat eine höhere und
die de-Gruppe eine niedrigere Energie.
Die Energiedifferenz D ("Kristallfeldaufspaltungsenergie")
zwischen den beiden d-Orbitalgruppen entscheidet darüber, welche
Komplextypen gebildet werden.
Ist die Differenz D gering, so verteilen sich die
3d-Elektronen gleichmäßig über beide d-Orbitalgruppen. Es bildet sich ein
Anlagerungs-, Outer-orbital- bzw. High-spin-Komplex. (Das zeigt das obere Bild.)
Ist die Differenz D groß, so ist es günstiger, wenn sich alle 3d-Elektronen in der
energetisch tiefgelegenen de-Orbitalgruppe versammeln. In diesem Fall bildet
sich ein Durchdringungs-, Inner-orbital- bzw. Low-spin-Komplex.
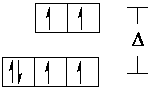
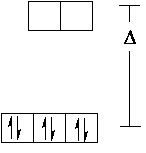
| [FeII(H2O)6]2+ | [FeII(CN)6]4- | |
 |
 |
|
| High-spin-Komplex
Outer-orbital-Komplex Anlagerungs-Komplex hoch paramagnetisch |
Low-spin-Komplex
Inner-orbital-Komplex Durchdringungs-Komplex nicht paramagnetisch |
| Bild 3: 3d-Orbital-Aufspaltung zweier Fe(II)-Komplexe |
2 Die spektroskopische Ligandenreihe
Auf welche Art sich ein bestimmter Ligand auf die Aufspaltung der d-Orbitale
auswirkt, muss empirisch untersucht werden. Das hängt direkt zusammen mit der
experimentellen Bestimmung der Differenz D. Dies geschieht spektroskopisch. Man
untersucht dabei, wie unter Einstrahlung von UV oder sichtbarem Licht Elektronen
aus dem de- in das dg-Orbital gehoben werden.
Das setzt voraus, dass sich im dg-Orbital freie Plätze befinden.
Die Farbigkeit der Komplexe sagt also grob etwas über die Größe von D
aus. Zum Beispiel ist der Aqua-Komplex von Fe(II) blassgrün (absorbiert also Orange), der Cyano-Komplex ist gelb
(absorbiert also Violett). Ersterer benötigt zur Anregung der d-Elektronen also eine geringere Energie D
(längerwellige Strahlung) als der andere (kurzwelligere Strahlung). Farblose
Komplexe lassen sich nur spektroskopisch beurteilen, da sie UV- (großes D) oder
IR-aktiv (sehr kleines D) sein können.
Ein anderes bekanntes Beispiel: Der hellblaugrüne Komplex [Cu(H2O)4]2+ hat sein
Absorptionsmaximum bei der Komplementärfarbe Rot, also bei 800 nm. Der
dunkelblaue Komplex [Cu(NH3)4]2+ absorbiert dagegen bei Orange, nämlich um 600
nm. Das zeigt, dass die Einwirkung von Ammoniak auf das Zentralfeld des Cu2+-Ions
stärker ist als die des Wassers. Ammoniak hat also ein stärkeres Ligandenfeld oder
ein größeres D.
Mit solchen Erkenntnissen kann man eine spektroskopische Ligandenreihe
aufbauen. Im folgenden Beispiel sind einige bekannte Liganden entsprechend ihrer
Wirkung von schwach nach stark eingeordnet.
Br- < SCN- < Cl- < F- < H2O < edta < NH3 < CN- < CO
3 Ligandenfeldtheorie
Bei der Kristallfeldtheorie werden die Bindungen zwischen Zentralteilchen und
Liganden als rein ionisch angenommen. Damit kann man zwar vieles erklären, nicht
aber die spektroskopische Ligandenreihe. Es ist einzusehen, dass das F--Ion als
kleine Punktladung ein stärkeres elektrostatisches Feld als ein Br--Ion und eine
größere Aufspaltung D bewirkt. Wie erklärt man dann aber die Auswirkung von
NH3 auf die inneren Orbitale? So ist das grüne [CoF6]3-
ein Outer-orbital- bzw. High-spin-Komplex, das gelbe [Co(NH3)6]3+
dagegen ein Inner-orbital- bzw. Low-spin-Komplex.
Man muss offensichtlich auch die energetische Wechselwirkung der Molekülorbitale des Liganden mit den Orbitalen des Zentral-Ions und die Bildung der bindenden, nichtbindenden und antibindenden s-Molekülorbitale (MO) der gesamten Komplexeinheit mit berücksichtigen. Das tut die Ligandenfeldtheorie, auf die wir in dieser Webseitensammlung nicht weiter eingehen wollen. Kurzgesagt ist sie aber nichts anderes als die Anwendung der Regeln der MO-Theorie auf die Bildung von Komplexen.
Klick mich an!
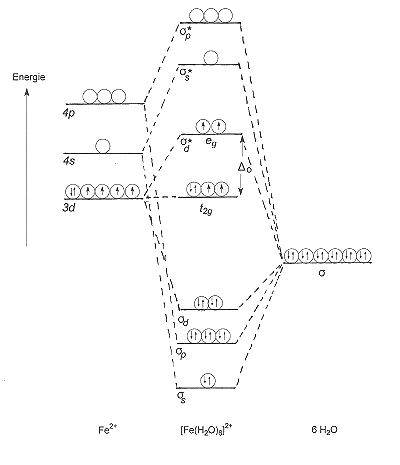 |
| Bild 4: Termschema von oktaedrischen Komplexen nach der Ligandenfeldtheorie |
Dennoch zeigen wir hier das Termschema von oktaedrischen Fe(II)-High-Spin-Komplexen. Links
stehen die Atomorbitale (AO) des Zentralteilchens Fe2+, rechts
die sechs Molekülorbitale (MO) eines Liganden wie z. B. F- oder H2O. Es handelt
sich um nichtbindende Elektronenpaare. Beim H2O sind dies s-Orbitale.
Die AOs und die MOs kombinieren zu den sechs bindenden s-Orbitalen des
Komplexes: sd, sp und
ss (Mitte). Von den antibindenden Orbitalen
s* sind die zu sp und
ss gehörenden leer, üben also keinen störenden
Einfluss auf die s-Bindungen zwischen Zentralteilchen und Liganden aus.
Die d-Elektronen des Zentralteilchens nehmen nicht an der Komplexbildung teil, denn sie befinden sich im nichtbindenden t2g-Orbital und im antibindenden eg-Orbital, dem s*d. Sie sind in unserem Beispiel durch ein kleines D getrennt. Deshalb sind nach der Hundschen Regel beide besetzt. Damit lassen sie aber auch keinen Platz für Liganden-Elektronen. Hinzu kommt, dass das antibindende eg-Orbital die sd-Bindung lockert. Insgesamt ist der Komplex relativ instabil; es handelt sich also um einen Outer-orbital- oder Anlagerungskomplex.
Weitere Texte zum Thema „Komplexverbindungen“