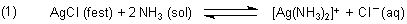
Silberhalogenide: Schwerlösliches wird durch Komplexbildung löslich
Experimente:
Versuch: Silberhalogenide lösen sich unter Komplexbildung
Versuch: "Fällungskaskade" von Silberkomplexen
Versuch: Wir entwickeln ein Schwarzweiß-Foto
Silberhalogenide sind schwerlösliche Salze. Wenn man jedoch bestimmte Komplexbildner zugibt,
scheinen sich die Halogenide leicht aufzulösen (-> Versuch).
Das nutzt man in der qualitativen Analyse zur Bestimmung der drei Halogenid-Ionen Cl-,
Br- und I- aus.
Wenn beispielsweise zum Silberchlorid der Komplexbildner Ammoniak zugegeben wird, löst sich der Niederschlag rasch auf. Es bildet sich der lösliche Di-Ammin-Silber-Komplex.
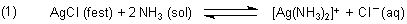
Wir sehen, dass es sich hier nicht um Auflösung des Niederschlags im physikalischen Sinne handelt, sondern um eine echte chemische Zersetzung.
Insgesamt kommen in der Praxis drei Halogenide und drei Ligandenlösungen in Frage:
| Silberchlorid löst sich in Ammoniak-, Thiosulfat- und Cyanidlösungen. |
| Silberbromid löst sich in Thiosulfat- und Cyanidlösungen. |
| Silberiodid löst sich nur in Cyanidlösungen. |
Die unterschiedliche Bildungstendenz von Komplexen lässt sich auch schön im so genannten Kaskadenversuch zeigen: So wird das schwerlösliche Silberchlorid AgCl wieder in Lösung gebracht, wenn man etwas Ammoniak-Lösung zutropft. Gibt man zu der entstehenden klaren Lösung Kaliumbromidlösung, so fällt gelbliches Silberbromid aus. Das wiederum löst sich in Thiosulfatlösung. Aus der resultierenden Komplexlösung fällen wir durch Zusatz von Kaliumiodidlösung tiefgelbes Silberiodid, das anschließend durch etwas Cyanidlösung zersetzt werden kann.
Was ist der Grund für die Zersetzung?
Zur Erklärung des Phänomens muss man die Reaktion in zwei Schritte unterteilen. Zunächst gibt es das
Dissoziationsgleichgewicht des schwerlöslichen Salzes im Wasser.
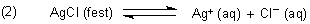
Die Gleichgewichtskonstante ist das Löslichkeitsprodukt.
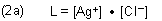
In Gegenwart eines Komplexbildners schließt sich das Bildungsgleichgewicht des Komplexes an.
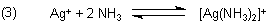
Das Gleichgewicht können wir umgekehrt auch als Dissoziationsgleichgewicht formulieren. Dann ist die Gleichgewichtskonstante die Komplex-Dissoziationskonstante.
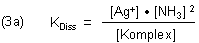
Die Silber-Ionen des Löslichkeitsgleichgewichts werden durch Komplexbildung entzogen. Das Salz zersetzt sich somit.
(Man kann die Zersetzung von Silberchlorid mit Ammoniaklösungen mit dem Schmelzen von Eis beim Streuen mit Salz vergleichen (siehe Winterdienst). Auf dem Eis befindet sich luftdruckbedingt stets ein feiner Wasserfilm. Dieser wird ständig mit Hilfe des von außen hinzu kommenden Salzes abgelöst. Der Wasserfilm bildet sich kontinuierlich nach. Das hat zur Folge, dass das Eis schließlich ganz schmilzt und zu einer konzentrierten Natriumchloridlösung wird.)
Die Gleichgewichts-Konzentrationen der Silber-Ionen spielen die
entscheidende Rolle
Der Silber-Komplex bildet sich aber nur dann, wenn das Dissoziationsgleichgewicht genügend Ag+-Ionen
liefert. Ist das nicht der Fall, wird sich kein Komplex bilden. Das Salz zersetzt sich nicht.
Hier sei die Kaskade schrittweise erklärt:
Wenn die Konzentration an Ag+-Ionen im Komplex-Dissoziationsgleichgewicht (3) niedriger ist als
im Lösungsgleichgewicht (2), ist die Komplexbildung bevorzugt gegenüber der Rückbildung des schwerlöslichen
Salzes. Das führt dazu, dass zur Komplexbildung (3) ständig alle Ag+-Ionen aus dem Lösungsgleichgewicht
(2) abgezogen werden. Diese müssen aber entsprechend dem Gleichgewicht (2) kontinuierlich nachgeliefert werden.
Somit zersetzt sich das Chlorid entsprechend Gleichung (1) zunehmend in der Ammoniaklösung.
Beim Bromid ist es anders. Das ist so schwer löslich, dass die Konzentration der freien Ag+-Ionen, die aus dem Lösungsgleichgewicht wie (2) stammen, geringer ist als die Konzentration der Silber-Ionen aus dem Komplex-Dissoziationsgleichgewicht. Folglich zersetzt sich Silberbromid nicht in Ammoniaklösung. Hierzu ist Thiosulfat notwendig.
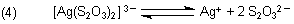
Dessen Silber-Komplex ist stabiler als der mit Ammoniak.
Last but not least gilt die gleiche Argumentation für das Silberiodid, das sich in Cyankali-Lösungen unter Komplexbildung zersetzt.
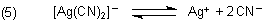
Der ist wiederum stabiler als der Thiosulfatkomplex.
Noch schwerer löslich als die Silberhalogenide ist übrigens Silbersulfid Ag2S, das man durch Einleiten von Schwefelwasserstoff in eine stark saure Lösung von Silbersalzen erhält. Dieses kann sogar aus Silbercyanatkomplexlösungen ausgefällt werden.
Kann man eine einfache quantitative Voraussage treffen?
Hierzu muss man die Gleichgewichtskonstanten zu Rate ziehen. Aus ihnen berechnet man für beide Gleichgewichte
(wie zum Beispiel (2) und (3)) die Konzentrationen der Ag+-Ionen. Im Falle des Löslichkeitsgleichgewichts ist die
Rechnung einfach. Ganz anders ist es beim unübersichtlichen Ausdruck für das Dissoziationsgleichgewicht des
Komplexes. Die in der Tabelle aufgeführten Silber-Ionenkonzentrationen wurden deshalb elektrochemisch ermittelt.
|
Vergleichen wir die Silber-Ionenkonzentrationen der Tabelle miteinander, so wird überhaupt nicht deutlich, warum sich die Niederschläge unter Komplexbildung zersetzen.
Es muss jedem klar werden, dass die Werte in der Tabelle echte Gleichgewichtskonstanten sind. Zur Bestimmung legt man eine definierte Menge des Komplexsalzes oder des Halogenids vor und lässt diese mit reinem Wasser als Lösungsmittel ins Gleichgewicht kommen. Erst dann misst man (zum Beispiel mit Hilfe von Konzentrationsketten) die Silberkonzentration. Das heißt, dass die Ligandenkonzentrationen in stöchiometrischen Verhältnissen zu den jeweiligen Silber-Ionenkonzentrationen und zur Komplexkonzentration stehen.
Für die praktische Anwendung in unserem Spezialfall gibt es daher Einschränkungen:
| - | Erschwerend ist die dynamische Bildung der Komplexe und die Zunahme ihrer Konzentrationen während der Zersetzung des Halogenid-Niederschlags. Deshalb kennen wir nicht die für die Berechnung der [Ag+]-Konzentrationen notwendigen Konzentrationen der Komplexe. |
| - | Weiter sind auch die im praktischen Experiment überaus hohen Konzentrationen der Komplexbildner einzubeziehen. |
| - | Im Falle des Thiosulfats gibt es darüber hinaus mehrere Arten von Silberkomplexen. |
All diese offenen Verhältnisse erschweren die Berechnung.
Ein Hinweis an die Unterrichtenden: Versuchen Sie deshalb nicht, in diesem Zusammenhang irgendetwas bis ins letzte Detail quantitativ zu berechnen. Dann springen Ihnen die Schüler sicherlich von der Stange...
Gibt es auch eine technische Anwendung?
Jawohl - in der Chemie des fotografischen Prozesses.
Die chemische Grundlage der Fotografie ist bekanntlich die Lichtempfindlichkeit von Silberbromid. Nach der
Entwicklung löst man das nicht belichtete Silberbromid beim Fixiervorgang (->
Versuch) mit Lösungen von Natrium-Thiosulfat (Fixiersalz) heraus.
Früher nahm man zum Fixieren gern das (wie wir gesehen haben) wirksamere Kaliumcyanid. Zu dieser Zeit war
es zusätzlich guter Brauch von Foto-Schaffenden, und ist es auch noch, zur künstlerischen Beflügelung ein (oder
auch mehr) Fläschchen Bier mit in die Dunkelkammer zu nehmen. Andererseits haben nachlässige Menschen die
extrem giftigen Cyanidlösungen in just solche Getränkeflaschen abgefüllt. So gab es immer wieder Anlass zu
unerquicklichen Unfällen.
Deshalb wurde die Verwendung von Cyanid als Fixierer nach und nach ziemlich unpopulär, in professionellen
Entwicklungsanstalten sogar verboten. (Im Kleingewerbe arbeiten nur die Goldschmiede noch mit Cyanidlösungen.)
Übrigens ist auch die Thiosulfatlösung nicht unproblematisch, was die Gesundheit angeht. Aber sie schmeckt wenigstens nicht nach Mandellikör und wird deswegen nicht ohne weiteres getrunken.
Weitere Texte zum Thema „Komplexverbindungen“